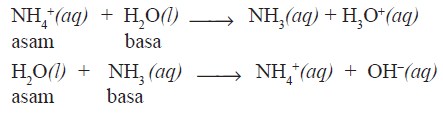Teori Asam dan Basa Menurut Bronsted-Lowry
Menurut Bronsted-Lowry menyatakan bahwa senyawa HCl bersifat asam karena dalam larutannya menghasilkan ion H+, sedangkan NaOH bersifat basa karena dalam larutannya melepaskan ion OH–. Teori asam-basa Arrhenius ini berlaku jika dalam keadaan berikut.
- Senyawa yang terlibat dalam reaksi harus dalam bentuk larutan.
- Suatu senyawa dikatakan bersifat asam jika dalam larutannya menghasilkan ion H+, sedangkan suatu senyawa dikatakan bersifat basa jika dalam larutannya melepaskan ion OH–.
Tetapi dalam kenyataan di alam ternyata ada fakta yang tidak mematuhi aturan Arrhenius tersebut, antara lain:
1. Gas HCl dan gas NH3 dapat langsung bereaksi membentuk NH4Cl.
HCl(g) + NH3(g) ⎯⎯→ NH4Cl(s)
2. Larutan Na2CO3 jika dites dengan indikator menunjukkan sifat basa padahal dalam senyawa tersebut tidak mengandung ion OH–.
.jpg)
Berdasarkan fakta di atas, maka dapat disimpulkan bahwa teori asam-basa Arrhenius belum bisa menjelaskan semua fenomena reaksi kimia. Oleh karena itu perlu ada teori asam-basa yang baru yang lebih mampu menjelaskan fenomena reaksi kimia.
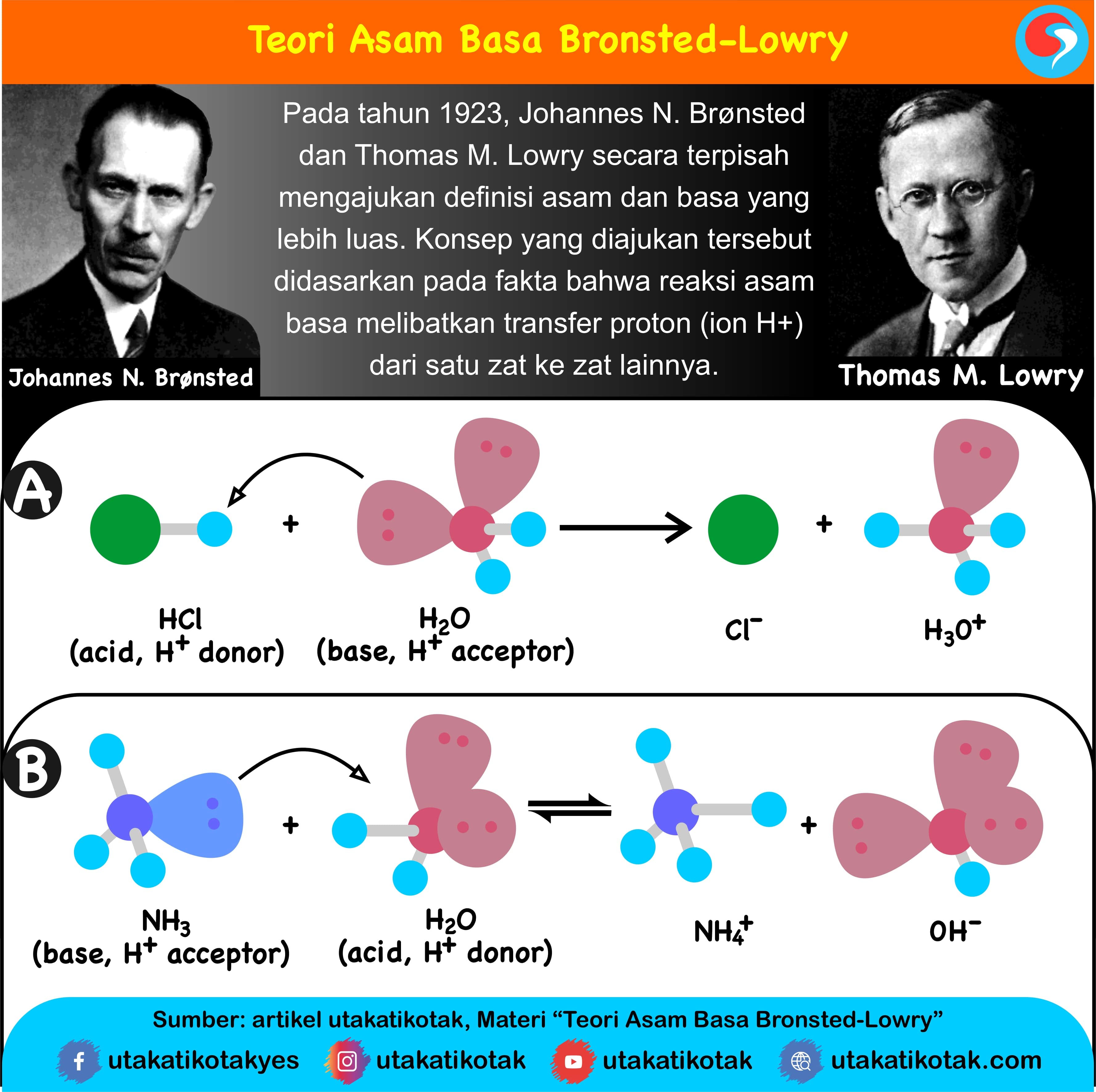
Menanggapi kekurangan teori asam-basa Arrhenius tersebut, pada tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris yang bekerja sendiri-sendiri, tetapi dalam waktu yang bersamaan mengembangkan konsep asam-basa berdasarkan serah-terima proton (H+). Konsep asam-basa berdasarkan serah-terima proton ini dikenal dengan konsep asam-basa Bronsted-Lowry.
Baca Juga :
Reaksi Asam Basa dan Reaksi Penetralan Dalam Kimia
Daftar Asam - Basa Kuat dan Lemah
Pengertian Asam dan Basa Menurut Bronsted-Lowry
Menurut Bronsted dan Lowry, asam adalah spesi yang memberi proton, sedangkan basa adalah spesi yang menerima proton pada suatu reaksi pemindahan proton.
- Asam Bronsted-Lowry = donor proton (H+)
- Basa Bronsted-Lowry = akseptor proton (H+)
Perhatikan contoh di bawah ini:
Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (donor proton) dan sebagai basa (akseptor proton). Zat seperti itu bersifat amfiprotik (amfoter).
Perbandingan Konsep Asam-Basa
Konsep asam-basa dari Bronsted-Lowry ini lebih luas daripada konsep asam-basa Arrhenius karena hal-hal berikut.
- Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.
- Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa Bronsted-Lowry dapat menjelaskan sifat asam dari NH4Cl. Dalam NH4Cl, yang bersifat asam adalah ion NH4+ karena dalam air dapat melepas proton.
Itulah penjelasan mengenai Pengertian Asam dan Basa Menurut Bronsted-Lowry yang dapat kami share pada kesempatan kali ini, semoga bermanfaat.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...