Pergeseran Kesetimbangan dan Faktor-faktor yang Mempengaruhinya
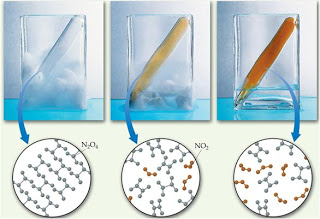
Keadaan setimbang pada suatu sistem merupakan keadaan yang stabil jika tidak ada pengaruh dari luar sistem. Jika diberikan suatu pengaruh (aksi) terhadap kesetimbangan, sistem tersebut akan bergeser menuju kesetimbangan yang baru.
Pada kesetimbangan baru ini, komposisi zat zat yang terlibat dalam kesetimbangan berubah dari komposisi semula.
Azas Le Chatelier adalah azas yang digunakan untuk memprediksi pengaruh perubahan kondisi pada kesetimbangan kimia. Azas Le Chatelier berbunyi:
“Jika suatu sistem kesetimbangan menerima suatu aksi, maka sistem tersebut akan mengadakan suatu reaksi sehingga pengaruh aksi menjadi sekecil-kecilnya”
Cara sistem melakukan reaksi adalah dengan melakukan pergeseran ke kiri atau ke kanan. Pergeseran ke kiri artinya laju reaksi ke arah kiri menjadi lebih besar dan pergeseran ke kanan artinya laju reaksi ke kanan menjadi lebih besar.
Baca juga: Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
Dalam ilmu kimia, Azas Le Chatelier digunakan untuk memanipulasi hasil dari reaksi bolak-balik (reversibel) bahkan bisa juga untuk memperbanyak produk reaksi. Asas Le Chatelier hanya berlaku untuk kesetimbangan dinamis.
Faktor – Faktor yang Mempengaruhi Pergeseran Kesetimbangan
Jika ke dalam sistem reaksi yang berada dalam keadaan kesetimbangan diberi gangguan, misalnya konsentrasi atau suhunya diubah, apa yang terjadi?.
Menurut Le Chatelier, jika sistem yang berada dalam keadaan kesetimbangan diganggu, sistem akan berusaha mengurangi gangguan dengan cara menggeser posisi kesetimbangan, baik ke arah pereaksi maupun hasil reaksi sehingga gangguan tersebut minimum dan tercapai keadaan kesetimbangan yang baru.
Berikut faktor – faktor yang dapat menyebabkan pergeseran kesetimbangan, yaitu:
-
Konsentrasi, apabila zat reaktan ditambahkan konsentrasinya, maka kesetimbangan akan bergeser ke arah pembentukan produk
-
Tekanan, apabila tekanan diperbesar, maka volume akan mengecil, sehingga kesetimbangan akan bergeser ke jumlah mol yang kecil.
-
Volume, apabila volume diperbesar, maka tekanan akan mengecil, sehingga kesetimbangan akan bergeser ke jumlah mol yang besar.
-
Suhu/Temperatur, apabila suhu dinaikkan, maka reaksi akan bergeser ke arah reaksi endoterm (reaksi yang menyerap panas).
Baca juga: Kesetimbangan Kimia
Penerapan Kesetimbangan dalam Industri
Pada bagian ini akan dibahas bagaimana proses produksi amonia (NH3) dan asam sulfat (H2SO4) dalam industrI. Kedua bahan kimia tersebut dalam proses pembuatannya melibatkan reaksi kesetimbangan, yang merupakan tahap paling menentukan untuk kecepatan produksi.
1. Pembuatan Amonia (NH3) menurut proses Haber-Bosch
Kebutuhan senyawa nitrogen semakin banyak, misalnya untuk industri pupuk, dan bahan peledak. Oleh karena itu, proses sintesis senyawa nitrogen, fiksasi nitrogen buatan, merupakan proses industri yang sangat penting. Metode yang utama adalah mereaksikan nitrogen dengan hidrogen membentuk amonia. Selanjutnya amonia dapat diubah menjadi senyawa nitrogen lain seperti asam nitrat dan garam nitrat.
2. Pembuatan Asam Sulfat
Asam sulfat merupakan bahan industri kimia yang penting, yaitu digunakan sebagai bahan baku untuk pembuatan pupuk. Proses pembuatan asam sulfat (H2SO4)sebenarnya ada dua cara, yaitu dengan proses kamar timbal dan proses kontak. Proses kamar timbal sudah lama ditinggalkan karena kurang menguntungkan. Proses kontak menghasilkan asam sulfat mencapai kadar 99% dan biayanya lebih murah.
Artikel Terkait
- Suatu batang AB memiliki panjang 0,9 meter dan massanya diabaikan. Di titik A digantung beban 35 kg dan di titik B sebesar 40 kg. Agar batang setimbang, maka harus diletakkan penumpu pada jarak dari B
- Dari gambar berikut, urutan untuk benda- benda yang berada dalam keseimbangan stabil, indifferent, labil
- Rumus Tetapan Kesetimbangan Air (Kw)
- Titik Berat dan Keseimbangan Benda Tegar
- Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
- Faktor - faktor yang Mempengaruhi Kesetimbangan Kimia
- Memahami Kesetimbangan Benda Tegar Melalui Pembahasan Soal
- Kesetimbangan Kimia
- Kesetimbangan Kimia ( Pembahasan Soal tetapan kesetimbangangan Kc )
- Titrasi Asam Basa