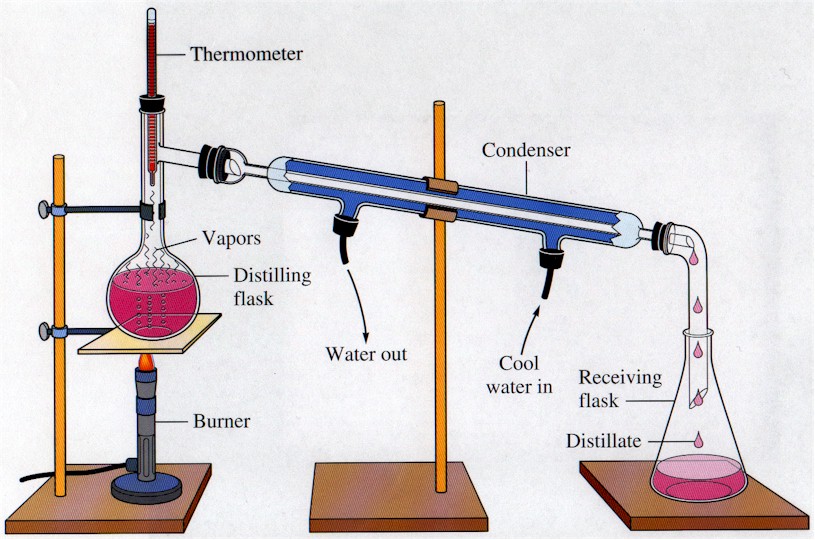
Pemisahan Campuran : Distilasi
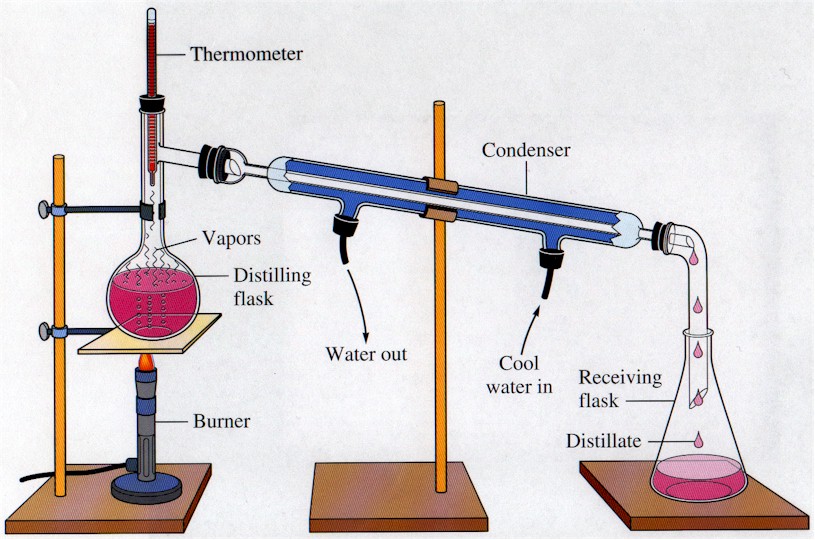
Salah satu pemisahan campuran ialah distilasi. Distilasi merupakan pemisahan campuran yang didasarkan oleh perbedaan titik didih. Dalam mempelajari distilasi, kita harus lebih mengenal tentang tekanan uap, titik didih Dalam mempelajari distilasi, kita harus lebih mengenal tentang tekanan uap, titik didih, larutan lewat panas dan “bumping” dan diagram tekanan uap campuran 2 macam zat cair.
1. Tekanan Uap
Seperti yang kita tahu, beberapa larutan akan menguap dan menghasilkan uap, pada suatu saat uap tersebut akan mencapai kesetimbangan dengan larutannya. maka Tekanan uap ialah tekanan suatu uap pada kesetimbangan dengan dengan fasa non-uapnya.
Tekanan Uap suatu cairan yang ditambahkan oleh zat lain maka akan berubah. Hal tersebut dijelaskan pada hukum Raoult, yaitu:
PA=XAPoA
PA= Tekanan uap Larutan
XA= Fraksi mol pelarut
PoA= Tekanan uap pelarut
2. Titik Didih
Titik didih adalah suhu dimana uap cairan sama dengan tekanan luar, sehingga di dalam seluruh zat cair terjadi kecenderungan untuk berubah dari fasa cair kefasa uap. Titik didih normal ialah titik didih zat cair yang di ukur pada tekanan udara 1 atm. Titik didih cairan murni berbeda dengan titik didih campuran, yang oleh Raoult di buatkan koreksi:
Δt = Kd . m
Δt = Kenaikan titik didih
Kd= Konstanta kenaikan titik didih yang bergantung pada pelarutnya
m = molalitas zat terlarut
3. Larutan Lewat Panas dan “Bumping”
Pada proses mendidih, mula – mula akan terjadi gelembung uap yang kecil, gelembung ini merupakan “benih” untuk terjadi gelembung uap yang lebih besar.. Kemudian naik ke permukaan cairan dan lepas keluar dari cairan sehingga terbentuk uap. Jika proses pembentukan gelembung teratur maka akan terjadi pendidihan yang teratur dan merata diseluruh bagian zat cair. namun jika pembentukan “benih” terhambat, maka ketika zat cair dipanaskan suhu akan meningkat dengan cepat melampaui titik didihnya dan benih gelembung belum terjadi, suatu saat jika terbentuk gelembung uap maka gelembung ini akan memiliki tekanan yang sangat besar, maka dengan cepat gelembung tadi membesar, naik ke permukaan dan pecah dengan kuat. Peristiwa ini menyebabkan pendidihan yang tidak teratur dimana cairan ikut memercik dengan kuat karena pecahnya gelembung tersebut. Keadaan ini disebut “Bumping”
Untuk menghindari hal tersebut maka perlu ditambahkan zat anti bumping. zat anti bumping ini ialah batu didih.
Baca juga :
Macam-Macam Pemisahan Campuran
Pengertian dan Contoh Pemisahan Campuran
Yuk Ketahui Pemisahan Komponen Kimia dalam Campuran
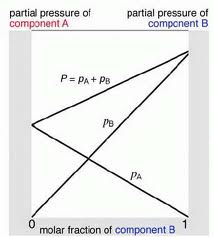
4. Diagram Tekanan Uap Campuran 2 Macam Zat Cair
Menurut hukum Raoult tekanan uap suatu senyawa sebanding dengan jumlah mol senyawa yang terdapat dalam campuran. misalnya saja ada senyawa A dan B
untuk tekanan parsial A :
PA=XAPoA
XA= Fraksi mol pelarut
PoA= Tekanan uap pelarut
Sedangkan yang B :
PB=XBPoB
PB= Tekanan uap Larutan
XB= Fraksi mol pelarut
PoB= Tekanan uap pelarut
lalu kita akan membuat pula fraksi mol uap yang dirumuskan
XuA = Pa/(Pa+Pb)
untuk XuB sebaliknya
persamaan persamaan tersebutlah yang digunakan untuk membuat kurva tekanan uap campuran dua zat cair yang ideal
5. Distilasi
perlu diketahui distilasi ialah salah satu pemisahan campuran yang memiliki prinsip sederhana namun tetap memiliki variasi dengan kekuatan dan kelemahan tertentu. Secara umum pada distilasi ada labu distilasi, pemanas, kolom distilasi dan labu penerimanya. jadi mula mula labu distilasi yang berupa cairan dipanaskan, lalu uapnya akan naik ke kolom. Zat yang memiliki titik didih tinggi yang terbawa menguap akan mencair lagi pada kolom. zat yang titik didihnya lebih rendah akan terus terbawa hingga di labu penerima. diberikut diantaranya
5.1 Distilasi Sederhana
Pada proses distilasi sederhana, campuran larutan yang dipanaskan akan menguap. distilasi sederhana ini cocok untuk memisahkan campuran 2 zat yang memiliki titik didih yang cukup jauh beda. Zat yang lebih mudah menguap akan menguap lebih dahulu sehingga yang tersisa hanyalah zat yang titik didihnya lebih tinggi. Hal ini bisa diulangi beberapa kali untuk mendapatkan hasil dan pemisahan yang lebih baik
5.2 Distilasi Bertingkat
Secara Prinsip distilasi bertingkat ini ialah distilasi sederhana yang hasil distilasinya dilakukan distilasi ulang. Hal ini dilakukan berulang ulang bergantung dari panjang kolom distilasi yang disesuaikan dengan sifat komponen campuran sehingga dihasilkan masing masing komponen yang murni. Distilasi bertingkat ini dapat digunakan untuk memisahkan campuran yang memiliki lenih dari dua komponen sehingga diperlukan suatu rancangan bentuk kondensor yag khusus. Distilasi bertingkat ini digunakan untuk memisahkan komponen komponen minyak bumi
5.3 Distilasi Vakum
Prinsip dari Distilasi Vakum ini yaitu dengan cara menurunkan tekanan diatas permukaan cairan dengan bantuan pompa vakum, maka cairan yang didistilasi akan mudah menguap, karena cairan ini akan mendidih dibawah titik didih normalnya. Hal ini sangat menguntungkan untuk mendistilasi campuran yang senyawaan penyusunnya mudah rusak atau terurai pada titik didihnya atau untuk menguapkan campuran yang sangat pekat karena penguapannya tidak memerlukan panas yang tinggi
5.4 Distilasi Uap
Distilasi uap merupakan metode untuk isolasi suatu senyawa atau memurnikan suatu senyawa. Pada cara ini digunakan suatu cairan yang tidak saling melarutkan akan mengikuti hukum dalton. Menurut Dalton, tekanan yang dihasilkan oleh campuran gas yang tidak bereaksi sama dengan jumlah tekanan masing masing uap, jika uap itu berada sendirian dalam bejananya
P=P1+P2+P3P……+Pn
Jika suatu campuran yang tidak saling bercampur dipanaskan, titik didihnya merupakan suhu dimana jumlah tekanan tekanan uapnya sama dengan tekanan atmosfer, suhu ini akan lebih rendah dari pada titik didih senyawa yang paling mudah menguap. Jika sebagai zat cair pencampur digunakan air. Hal ini sangat menguntungkan untuk pemisahan senyawa yang dapat terurai pada suhu titik didihnya. Distilasi uap ini dipakai untuk menghasilkan minyak atsiri dari suatu tumbuhan. misalnya saja minyak kayu putih, minyak angin, atau suatu minyak dari dedaunan atau bunga apa saja.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...