KELARUTAN
Kelarutan (solubility) suatu zat di dalam suatu pelarut menyatakan jumlah maksimum suatu zat yang dapat larut di dalam suatu pelarut. Suatu kelarutan umumnya dinyatakan dalam gram/L atau mol/L.
Jika sejumlah garam dapur dilarutkan ke dalam air dan sebagian yang tidak dapat larut lagi, larutan tersebut merupakan larutan jenuh. Jika ke dalam larutan jenuh NaCl tersebut ditambahkan lagi NaCl, NaCl yang ditambahkan tersebut akan mengendap sebagai padatan NaCl. Dengan demikian, konsentrasi larutan sama dengan kelarutan NaCl dalam air.
FAKTOR YANG MEMPENGARUHI KELARUTAN
Besarnya kelarutan suatu zat dipengaruhi oleh beberapa faktor, antara lain:
1. Jenis pelarut
Senyawa polar (mempunyai kutub muatan) akan mudah larut dalam senyawa polar, misalnya alkohol dan semua asam merupakan senyawa polar sehingga mudah larut dalam air yang juga merupakan senyawa polar. Selain senyawa polar, senyawa ion seperti NaCl juga mudah larut dalam air dan terurai menajdi ion – ion. Senyawa nonpolar akan mudah larut dalam senyawa nonpolar, misalnya lemak mudah larut dalam minyak. Senyawa polar umumnya tidak larut dalam senyawa nonpolar, misalnya alkohol tidak larut dalam minyak tanah.
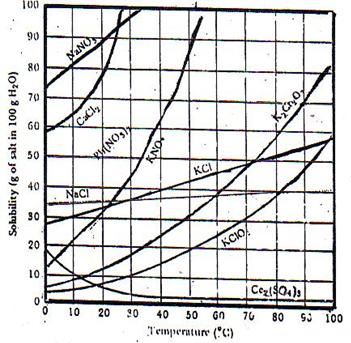
2. Suhu
Kelarutan zat padat dalam air akan semakin tinggi jika suhunya dinaikan. Hal ini disebabkan adanya kalor yang akan mengakibatkan semakin renggangnya jarak antar molekul pada zat padat tersebut. Merengganggnya jarak antara molekul pada molekul – molekul zat padat menjadikan kekuatan gaya antar molekul menjadi lemah sehingga mudah terlepas oleh adanya pengaruh gaya tarik molekul – molekul air. Grafik di bawahmenunjukan adanya pengaruh suhu terhadap kelarutan beberapa zat padat.
Berbeda dengan zat padat, kenaikan suhu akan menyebabkan kelarutan gas dalam air berkurang. Hal ini disebabkan suhu yang meningkat mengakibatkan gas yang terlarut di dalam air akan terlepas meninggalkan air.
Demikian tulisan mengenai kelarutan, semoga bermanfaat …..
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...