BENZENA : Struktur dan Senyawa Turunan
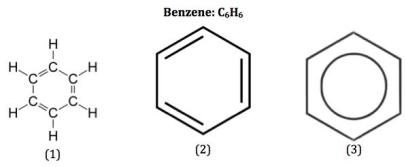
Dalam pembahasan Kimia tentang Benzena dan Turunannya di dalamnya dibahas tentang struktur Benzena. Dilihat dari sejarah yang ada bahwa untuk pertama kalinya benzena diisolasi pada tahun 1825 oleh Michael Faraday dari residu berminyak yang tertimbun dalam pipa induk gas di London. Kemudian pada tahun 1834 ditetapkan rumus molekul benzena adalah C6H6. Struktur yang mula-mula diusulkan pada tahun 1865 tidak mengandung ikatan rangkap karena benzena tidak mudah mengalami reaksi adisi seperti pada alkena. Struktur yang demikian ini tidak sesuai dengan tetravalensi karbon.
Struktur Benzena
Agar tidak menyalahi tetravelensi karbon, pada tahun 1872 Friedrich August Kekule mengusulkan bahwa benzena mengandung tiga ikatan tunggal dan tiga ikatan rangkap yang berselang-seling. Berikut rumus struktur Benzena:
 |
| Struktur Benzena |
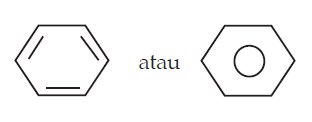
Rumus struktur di atas dapat disederhanakan penulisannya menjadi:
Pengukuran spektroskopik menunjukkan bahwa molekul benzena adalah planar dan semua ikatan karbon-karbonnya sama panjang yaitu 1,39 Å. Ikatan karbon-karbon pada benzena panjangnya di antara ikatan karbon-karbon tunggal (1,47 Å) dan ikatan karbon-karbon rangkap (1,33 Å). Hal ini dapat dibenarkan karena ikatan karbon-karbon pada benzena mengalami resonansi (berpindah-pindah). Inilah sebabnya mengapa benzena sukar mengalami adisi.
Baca Juga :
Sifat Senyawa dan Contoh Senyawa
Ikatan karbon-karbon pada benzena terdiri atas ikatan sigma (σ) dan ikatan pi (π). Menurut teori ini ikatan valensi orbital molekul terbentuk dari tumpang tindih orbital-orbital atom. Ikatan kovalen yang terbentuk dari tumpang tindih ujung dengan ujung disebut ikatan sigma (σ), sedangkan ikatan kovalen yang terbentuk dari tumpang tindih sisi dengan sisi disebut ikatan pi (π).
Contoh ikatan sigma (σ) dari tumpang tindih orbital p – p (ujung dengan ujung).

Contoh ikatan pi (π) dari tumpang tindih orbital p – p (sisi dengan sisi).
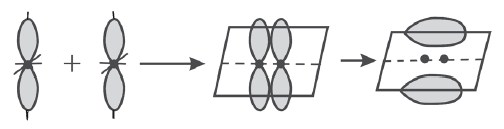
Ikatan yang pertama antara dua atom merupakan ikatan sigma, dan ikatan yang kedua merupakan ikatan pi. Jadi ikatan tunggal adalah ikatan sigma, dan ikatan kovalen rangkap dua terdiri atas ikatan sigma dan ikatan pi.
Benzena mempunyai enam karbon sp2 dalam sebuah cincin segi enam datar. Tiap atom karbon memiliki satu orbital p yang tegak lurus bidang cincin. Tumpang tindih keenam orbital p mengakibatkan terbentuknya enam orbital molekul π sehingga terbentuk awan elektron berbentuk “donat” pada bagian atas dan bawah cincin segi enam benzena.
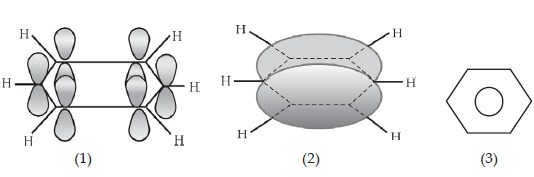
(1) Susunan 6 atom C masing-masing dengan 3 ikatan sigma dan 1 elektron p.
(2) Lambang keadaan elektron–elektron p yang terdelokasi.
(3) Lambang benzena.
Penjelasan Lain Mengenai Struktur Benzena
Ikatan rangkap pada benzena berbeda dengan ikatan rangkap pada alkena. Ikatan rangkap pada alkena dapat mengalami reaksi adisi, sedangkan ikatan rangkap pada benzena tidak dapat diadisi, tetapi benzena dapat bereaksi secara substitusi. Contoh:
- Reaksi adisi: C2H4 + Cl2 ⟶ C2H4Cl2
- Reaksi substitusi: C6H6 + Cl2 ⟶ C6H5Cl + HCl
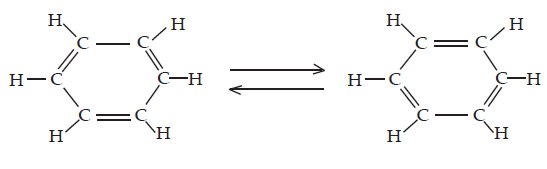
Menurut Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik membentuk segienam beraturan dengan sudut ikatan masing-masing 120°. Ikatan antaratom karbon adalah ikatan rangkap dua dan tunggal bergantian (terkonjugasi).
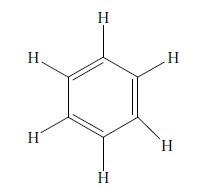
Analisis sinar-X terhadap struktur benzena menunjukkan bahwa panjang ikatan antaratom karbon dalam benzena sama, yaitu 0,139 nm. Adapun panjang ikatan rangkap dua C=C adalah 0,134 nm dan panjang ikatan tunggal C–C adalah 0,154 nm. Jadi, ikatan karbon-karbon pada molekul benzena berada di antara ikatan rangkap dua dan ikatan tunggal. Hal ini menggugurkan struktur dari Kekule.
Berdasarkan hasil analisis sinar-X maka diusulkan bahwa ikatan rangkap pada molekul benzena tidak terlokalisasi pada karbon tertentu melainkan dapat berpindah-pindah (terdelokalisasi). Gejala ini dinamakan resonansi. Untuk menggambarkan ikatan rangkap dua yang terdelokalisasi pada molekul benzena dinyatakan dengan bentuk lingkaran, seperti ditunjukkan berikut ini.
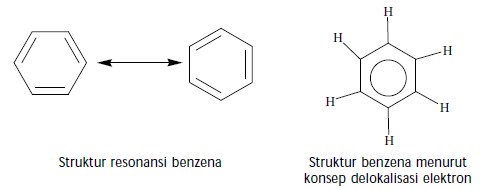
Teori resonansi dapat menerangkan mengapa benzena sukar mengalami reaksi adisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk cincin yang kuat terhadap reaksi kimia sehingga tidak mudah diganggu.
Pada suhu kamar, benzena berwujud cair dengan bau yang khas, tidak berwarna, bersifat racun, dan mudah terbakar. Titik didih benzena 80°C dan titik bekunya 5,5°C.
Benzena paling banyak digunakan sebagai pelarut senyawa karbon yang bersifat nonpolar dan sebagai bahan baku untuk pembuatan senyawa turunan benzena. Semua senyawa karbon yang mengandung cincin benzena digolongkan sebagai turunan benzena. Reaksi umum benzena adalah reaksi substitusi, yaitu penggantian atom H oleh gugus lain tanpa mengganggu cincin karbonnya.
Contoh:
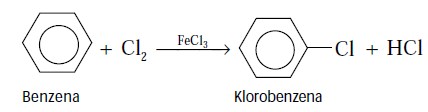
Senyawa Turunan Benzena
Berikut ini beberapa senyawa-senyawa turunan dari benzena beserta strukturnya masing-masing:
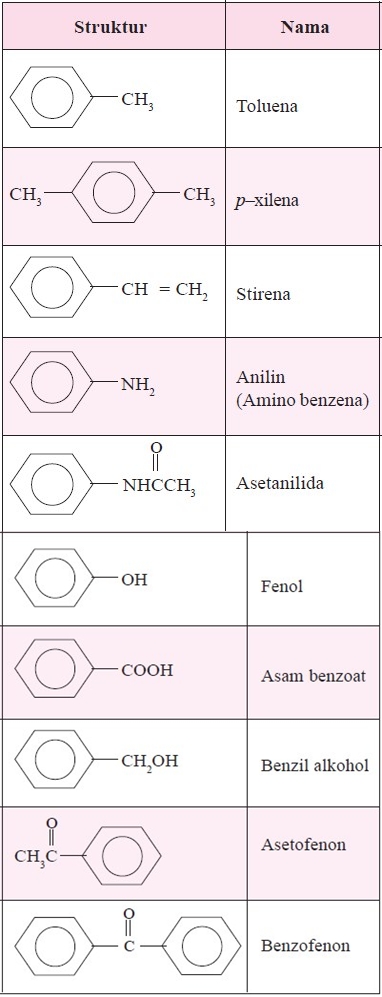
Demikian penjelasan kali ini seputar Struktur Benzena dan Senyawa Turunan Benzena. Semoga penjelasan di atas dapat dipahami, terlebih lagi kami berharap penjelasan di atas dapat menjadi referensi yang baik serta bermanfaat bagi kita semua.
Artikel Terkait
- Air Sangat Bermanfaat Khususnya Untuk Tubuh Kita, Karena 2/3 dari Tubuh Kita Terdiri dari Cairan. Tetapi Tidak Semua Air Itu Bisa Kita Konsumsi. Ada Syarat yang Harus Dipenuhi...
- Proses Alam yang Memecahkan Batuan Besar Menjadi Beberapa Bagian Batu Kecil dan Menghasilkan Perubahan Kimia pada Material Bahan Adalah...
- Campuran yang Tidak Dapat Dibedakan Antara Pelarut dengan Zat Terlarutnya Disebut? Jawaban dan Pembahasan
- Apa yang Dimaksud dengan Reduksi Bahan Berbahaya Dalam Kimia Hijau? Jawaban dan Pembahasan
- Kerajinan Atau Barang Jadi yang Terbuat dari Bahan Serat, Benang, Maupun Kain, yang Sebelumnya Merupakan Hasil Pengolahan Secara Kimia Disebut…
- Nilai Rata-rata Kimia Dalam Suatu Kelas Adalah 6,5. Jika Ditambah Nilai Siswa Baru yang Besarnya 9 Maka Rata-rata Menjadi 6,6. Banyak Siswa Semula...
- Zat Kimia yang Berfungsi Untuk Menghantarkan Rangsang Listrik Adalah? Jawaban Soal
- Cara yang Terbaik Untuk Melindungi Tiang Listrik dari Korosi Adalah ...
- Perubahan Materi di Bawah Ini yang Bukan Perubahan Kimia Adalah...
- Contoh Sifat Kimia dari Besi Adalah ...