Konfigurasi Elektron Berdasarkan Kaidah Oktet dan Duplet
Supaya stabil setiap unsur berusaha memiliki konfigurasi elektron seperti Gas Mulia yang memiliki elektron valensi 2 (kaidah duplet) atau 8 (kaidah oktet). Simak selengkapnya di bawah ini.
Suatu senyawa terbentuk dari unsur-unsur yang bergabung melalui ikatan kimia.Misalnya, senyawa air (H2O), yang terbentuk dari dua atom hidrogen (H) dan satu atomoksigen (O). Atom dari unsur H memiliki elektron valensi 1, sedangkan atom dari unsur oksigen memiliki elektron valensi 6. Kedua atom tersebut belum stabil. Agar staabil suatu atom harus memiliki eektron valensi 2 atau 8. Oleh karena itu, unsur H dan O yang kurang stabil bergabung membentuk senyawa H2O yang lebih stabil.
Molekul Air mengandung 2 atom Hidrogen dan 1 atom Oksigen
Jadi, setiap atom memiliki kecenderungan untuk mencapai kestabilannya dengan cara berikatan dengan atom lain. Bagaimanakah proses pembentukan ikatan tersebut? Untuk mengetahuinya, sobat harus memahami dulu konfigurasi elektron gas mulia, atom logam, dan atom nonlogam.
KAIDAH OKTET DAN DUPLET
1. Konfigurasi Elektron Gas Mulia
Unsur-unsur gas mulia terletak pada golongan VIIIA dalam sistem periodik unsur. Unsur-unsur gas mulia merupakan unsur-unsur yang inert (sukar bereaksi) sehingga banyak digunakan dalam industri yang memerlukan kondisi inert. Di alam, unsur-unsur gas mulia berada dalam bentuk atom bebas (monoatomik).
Dari keseluruhan unsur gas mulia, hanya tiga unsur yang diketahui dapat bereaksi dengan unsur lain. Reaksi tersebut sangat sukar terjadi dan hanya berlangsung pada kondisi-kondisi yang khusus. Tiga unsur gas mulia tersebut yaitu kripton (Kr), Xenon (Xe), dan Radon (Rn). Unsur gas mulia yang hingga saat ini belum diketahui apakh dapat bereaksi dengan unsur lain, yaitu Helium (He), Neon (Ne), dan Argon (Ar).
Perhatikan konfigurasi elektron gas mulia pada tabel di bawah.
| Unsur | Lambang | Nomor atom | Konfigurasi elektron | Elektron valensi |
| Helium | He | 2 | 2 | 2 |
| Neon | Ne | 10 | 2 8 | 8 |
| Argon | Ar | 18 | 2 8 8 | 8 |
| Kripton | Kr | 36 | 2 8 18 8 | 8 |
| Xenon | Xe | 54 | 2 8 18 18 8 | 8 |
| Radon | Rn | 86 | 2 8 18 32 18 8 | 8 |
 Menurut G.N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh elektron valensinya yang berjumlah delapan kecuali Helium yang hanya memiliki dua elektron. Menurut mereka, setiap atom dalam pembentukan senyawa membentuk konfigurasi elektron yang stabil, yaitu konfigurasi elektron yang stabil, yaitu konfigurasi elektron gas mulia yang disebut juga kaidah oktet (untuk Helium disebut kaidah duplet).
Menurut G.N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh elektron valensinya yang berjumlah delapan kecuali Helium yang hanya memiliki dua elektron. Menurut mereka, setiap atom dalam pembentukan senyawa membentuk konfigurasi elektron yang stabil, yaitu konfigurasi elektron yang stabil, yaitu konfigurasi elektron gas mulia yang disebut juga kaidah oktet (untuk Helium disebut kaidah duplet).
Atom-atom suatu unsur berusaha mencapai konfigurasi oktet (kaidah oktet) atau konfigurasi duplet dengan cara berikatan dengan atom-atom lain. Ikatan yang terjadi dapat berupa ikatan ion, ikataan kovalen, atau ikatan kovalen koordinasi.
Baca Juga :
Penemuan Model Atom dan Partikel Penyusunnya
Menentukan Bilangan Kuantum Dengan Benar
2. Konfigurasi Elektron dari Atom dengan Kecenderungan Melepaskan Elektron
Dalam pembentukan suatu senyawa, atom-atom unsur yang memiliki elektron valensi dalam jumlah sedikit, misalnya unsur-unsur golongan IA (kecuali atom H), IIA, dan IIIA, memiliki kecenderungan membentuk ion positif disebut unsur elektropositif. Nilai muatan positif yang terjadi sesuai dengan elektron valensi atom-atom tersebut. Perhatikan tabel di bawah.
Tabel pembentukan ion positif beberapa unsur
| Atom | Konfigurasi elektron atom | Jumlah elektron yang dilepas | Bentuk ion | Konfigurasi elektron ion (konfigurasi oktet) | Gas mulia yang sesuai |
| 11Na | 2 8 1 | 1 | Na+ | 2 8 | 10Ne |
| 19K | 2 8 8 1 | 1 | K+ | 2 8 8 | 18Ar |
| 12Mg | 2 8 2 | 2 | Mg+ | 2 8 | 10Ne |
| 20Ca | 2 8 8 2 | 2 | Ca2+ | 2 8 8 | 18Ar |
| 13Al | 2 8 3 | 3 | Al3+ | 2 8 | 10Ne |
Atom-atom unsur yang cenderung melepas elektron memiliki energi ionisasi relatif kecil. Unsur-unsur ini merupakan unsur-unsur logam (unsur elektropositif).
3. Konfigurasi Elektron dari Atom dengan Kecenderungan menerima Elektron
Dalam pembentukan suatu senyawa atom-atom unsur yang memiliki elektron valensi dalam jumlah banyak, misalnya unsur-unsur golongan IVA, VA, VIA, dan VIIA, yaang memiliki kecenderungan mengikuti kaidah oktet dengan cara menerima elektron untuk membentuk ion negatif. Unsur-unsur yang memiliki kecenderungan membentuk ion negatif disebut elektronegatif. Nilai muatan negatif yang terjadi adalah sejumlah elektron yang diterima, yaitu 8-x (dalam hal ini x adalah jumlah elektron valensi). Perhatikan tabel di bawah.
Tabel Pembentukan Ion Negatif Beberapa Unsur
| Atom | Konfigurasi elektron atom | Jumlah elektron yang diterima | Bentuk ion | Konfigurasi elektron ion (konfigurasi oktet) | Gas mulia yang sesuai |
| 9F | 2 7 | 8-7 = 1 | F– | 2 8 | 10Ne |
| 17Cl | 2 8 7 | 8-7 = 1 | Cl– | 2 8 8 | 18Ar |
| 8O | 2 6 | 8-6 = 2 | O2- | 2 8 | 10Ne |
| 16S | 2 8 6 | 8-6 = 2 | S2- | 2 8 8 | 18Ar |
| 7N | 2 5 | 8-5 = 3 | N3- | 2 8 | 10Ne |
| 15P | 2 8 5 | 8-5 = 3 | P3- | 2 8 8 | 18Ar |
Atom-atom unsur yang cenderung menerima elektron memiliki afinitas elektron atau keelektronegatifan yang relatif besar. Unsur-unsur ini merupakan unsur-unsur nonlogam.
Kesimpulan
Supaya stabil setiap unsur berusaha memiliki konfigurasi elektron seperti Gas Mulia yang memiliki elektron valensi dua (kaidah duplet) atau delapan (kaidah oktet) entah itu dengan cara menerima elektron ataupun melepas elektron. Namun sebenarnya ada juga yang tidak dengan cara kedua-duanya (melepas atau menerima elektron), melainkan dengan cara penggunaan pasangan elektron bersama.
Elektron Valensi
Elektron valensi ialah jumlah elektron pada kulit terluar suatu atom netral. Cara
menentukan elektron valensi adalah dengan menuliskan konfigurasi elektron.
Contoh soal:
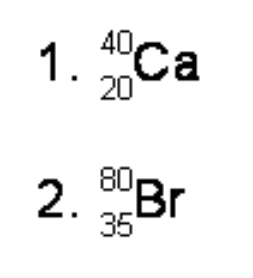
Tulislah konfigurasi elektron dan elektron valensi dari atom-atom berikut:
Jawab:
1. Nomor atom = 20, jumlah elektron=20
Konfigurasi elektron K=2 L=8 M=8 N=2
Elektron valensi =2
2. Nomor atom = 35
Konfigurasi elektron K=2 L=8 M=18 N=7
Elektron valensi =7
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...