Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr) adalah bagian awal dari materi perhitungan kimia. Dasar materi yang diberikan pada cara menghitung massa atom relatif (Ar) dan massa molekul relatif akan membantu memahami materi perhitungan kimia berikutnya. Sebelumnya, perlu mengetahui apa itu massa atom relatif (Ar) dan apa itu massa molekul relatif? Melalui halaman ini, akan mengulas jawaban dari pertanyaan tersebut.
Seperti namanya, massa atom relatif memiliki hubungan dengan berat suatu atom. Sedangkan massa molekul merujuk pada berat molekul yang merupakan kumpulan beberapa atom. Mengukur massa atom tidak bisa menggunakan neraca seperti untuk mengukur massa benda pada umumnya. Hal ini dikarenakan satu buah atom memiliki nilai massa yang sangat kecil. Dalam menyatakan satuan atom diperlukan sebuah satuan lain. Para ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic Massa Unit (amu) yang biasa disebut juga sebagai satuan Dalton untuk menyatakan massa atom.

Nantinya, massa atom relatif dan massa molekul relatif dapat digunakan dalam menentukan massa molar. Di mana, massa molar menyatakan massa yang dimiliki oleh 1 mol zat yang besarnya sama dengan Ar atau Mr. Materi tersebut akan dibahas lebih jauh pada materi konsep mol. Sebelumnya, simak cara menghitung massa atom relatif dan cara menghitung massa molekul relatif pada pembahasan di bawah.
Cara Menghitung Massa Atom Relatif (Ar)
Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap satu per dua belas massa atom C – 12. Skala massa atom relatif disimbolkan sebagai Ar.
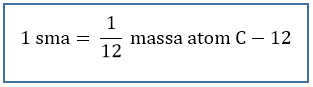
Massa atom relatif adalah massa suatu atom yang ditentukan dengan cara membandingkan dengan massa atom standar. Massa atom relatif, disingkat dengan Ar. Berdasarkan IUPAC (International Union of Pure and Applied Chemistry) yang digunakan sebagai standar penentuan massa atom relatif adalah atom C-12. Kemudian didapatkan rumus penentuan massa atom relatif (Ar) adalah perbandingan massa rata – rata unsur dengan satu per dua belas massa 1 atom C-12.
Contoh Cara Menghitung Massa Atom Relatif (Ar):
Diketahui massa 1 atom oksigen 2,70 x 10–23 g, jika massa atom C adalah 1,99 10–23 g maka massa atom relatif O (Ar O) adalah ….
Pembahasan:

Cara Menghitung Massa Molekul Relatif (Mr)
Setelah mempelajari cara menghitung massa atom relatif (Ar) berikutnya adalah cara menghitung massa molekul relatif (Mr). Biasanya massa atom relatif setiap unsur penyusun dari senyawa yang diberikan pada soal akan diberikan keterangan nilai Ar untuk masing – masing atom. Atau, dapat melihat nilai massa atom relatif pada tabel sistem periodik unsur.
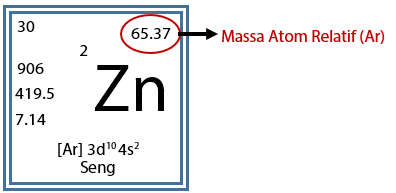
Massa molekul relatif (Mr) adalah jumlah total dari massa atom relatif unsur-unsur penyusunnya dalam suatu senyawa atau molekul. Massa molekul relatif (Mr) digunakan untuk senyawa atau molekul sedangkan massa atom relatif digunakan untuk unsur atau atom.
Rumus untuk menentukan massa molekul relatif (Mr) adalah:
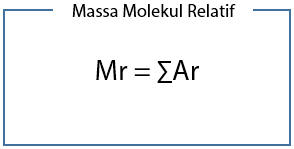
Contoh cara menghitung massa molekul relatif (Mr):
Hitunglah Mr H2SO4 (Ar: H = 1, S = 32, O = 16)!
Pembahasan:
+ 32 + 4 \times 16 \]" src="https://idschool.net/wp-content/ql-cache/quicklatex.com-2809524444ab35349798b011ca8cd126_l3.svg" style="height:13px; width:137px" title="Rendered by QuickLaTeX.com" />
+ 32 + 64 \]" src="https://idschool.net/wp-content/ql-cache/quicklatex.com-ad8d8c8cbf1af2b04a677c7d36019cf3_l3.svg" style="height:13px; width:87px" title="Rendered by QuickLaTeX.com" />
Demikianlah tadi ulasan materi cara menghitung massa atom relatif dan massa molekul relatif. Terimakasih sudah mengunjungi, semoga bermanfaat.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...