Teori Asam Basa Bronsted – Lowry Dalam ilmu Kimia
Pengertian Asam dan Basa ialah Dua Kata yang merupakan Senyawa Kimia dan mempunyai pengertian yang berbeda satu sama lain karena Pengertian Asam didalam ilmu Kimia ialah Senyawa Kimia yang jika dilarutkan didalam Air maka akan menghasilkan Larutan dengan pH yang lebih kecil dari 7. Senyawa Kimia Asam ini dapat memberikan Proton (Ion H+) kepada Zat lain yang disebut Basa atau bisa menerima Pasangan Elektrok Bebas dari Suatu Basa.
Sedangkan Pengertian Basa didalam ilmu Kimia adalah Senyawa Kimia yang mampu menyerap Ion Hidronium saat dilarutkan didalam Air dan Basa ini mempunyai pH yang lebih dari 7 (Kebalikan dari Asam). Contoh dari Asam sendiri antara lain Asam Asetat yang ada didalam Cuka dan Asam Sulfat yang ada didalam Baterai ataupun Aki Mobil, lalu Contoh dari Basa sendiri antara lain Basa Alumunium Hidroksida yang ada didalam Deodoran atau Antasida, Basa Natrium Hidroksida yang ada didalam Pembersih Saluran Pipa dan Basa Kalium Hidroksida yang ada didalam Sabun.
Adapun untuk Sifat – Sifat Asam dan Basa tentunya saling berbeda satu sama lain karena Sifat Asam antara lain tentunya mempunyai Rasa Asam, Larutan Asam dapat menghantarkan Arus Listrik, dapat mengubah Lakmus Warna Biru ke Lakmus Warna Merah, dapat menghasilkan Gas Hidrogen ketika beraksi dengan Logam, Asam dapat bereaksi dengan Basa yang membentuk Garam dan Air. Lalu Sifat – Sifat Basa sendiri antara lain memiliki Rasa Pahit, dapat mengubah Lakmus Warna Merah ke Warna Biru, Larutan Basa pun dapat menghantarkan Arus Listrik, berasa Licin dan Bersabun serta dapat beraksi dengan Asam dengan membentuk Garam dan Air.
Kemudian didalam Asam dan Basa Kimia ini terdapat 3 Teori Asam Basa terkenal yang masing – masing telah dikemukakan oleh Ahli Kimia dan Ilmuwan Kimia terkemuka di Dunia dan Ketiga Teori Asam dan Basa tersebut antara lain Teori Asam Basa Menurut Arrhenius, Teori Asam Basa Menurut Bronsted-Lowry dan Teori Asam Basa Menurut Lewis. Dari Ketiga Teori Asam Basa itu, yang akan pertama kali dibahas ialah Teori Asam dan Basa Bronsted – Lowry karena Teori ini yang paling mudah digunakan dari ketiga tersebut.
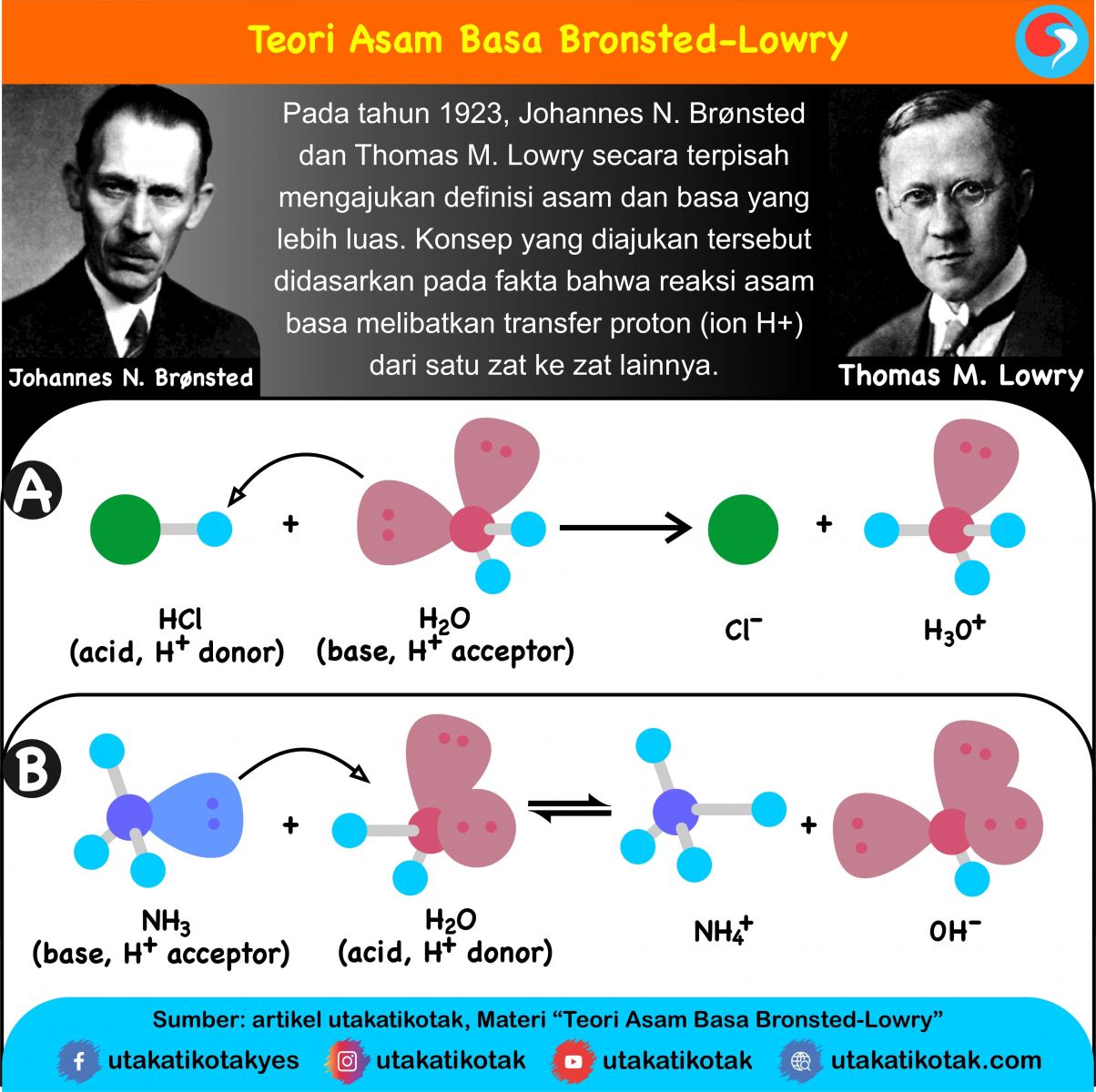
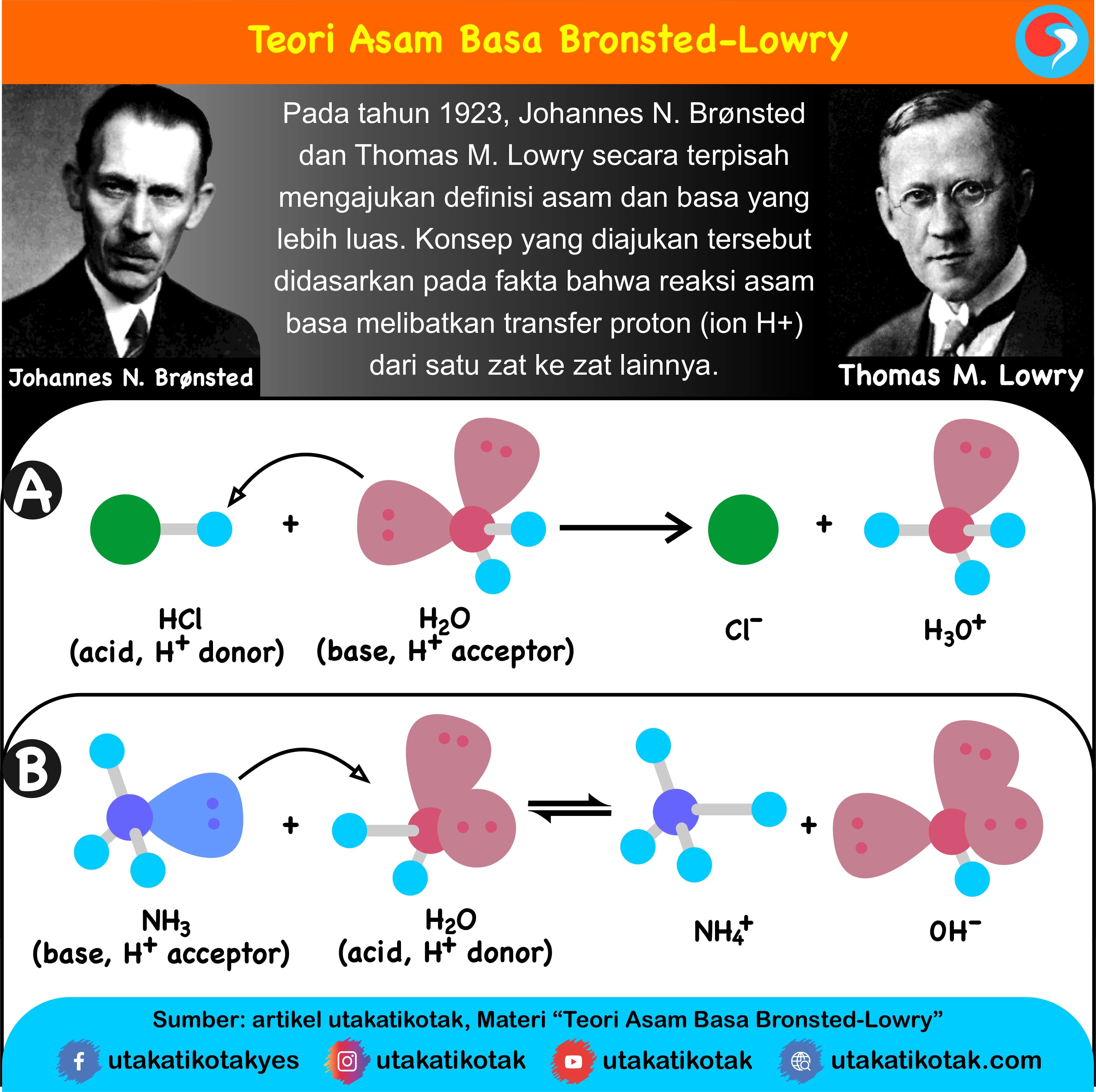
Teori Asam Basa Bronsted – Lowry diajukan secara terpisah oleh Dua Ilmuwan Kimia di tahun 1923 yakni Ilmuwan Johannes Nicolaus Bronsted berasal dari Denmark yang hidup di tahun 1879 – 1947 dan Ilmuwan Thomas Martin Lowry berasal dari Inggris yang hidup di tahun 1874 – 1936. Konsep Dasar Teori Asam Basa Bronsted-Lowry ini ialah ketika suatu Asam dan Basa bereaksi antara satu sama lain, maka asam akan membentuk suatu Basa Konjugatnya dan Basa membentuk Asam Konjugatnya melalui pertukaran Proton.
Lalu untuk Bunyi Teori Asam Basa Bronsted – Lowry bahwa Asam merupakan senyawa yang bisa menyumbangkan Proton yakni Ion H+ ke Senyawa (Zat) yang lain dan Basa ialah Senyawa yang bisa menerima Proton yakni Ion H+ dari Senyawa (Zat) yang lain. Menurut Bronsted dan Lowry bahwa Zat bisa berperan dengan baik sebagai Asam maupun Basa, jika Zat itu lebih dulu melepas Proton karena Zat ini nantinya akan berperan sebagai Asam dan lawannya sebagai Basa.
Namun sebaliknya jika Suatu Zat lebih mudah menerima Proton, maka Zat tersebut akan berperan sebagai Basa dan dalam suatu Larutan Asam dalam Air, Air tersebut berperan sebagai Basa. Air merupakan Zat Atmosfer yang khas dan contoh reaksi Zat Atmosfer tersebut ialah reaksi antara 2 molekul Air yang dapat menghasilkan Ion Hidronium dan Ion Hidroksida.
Perbandingan Teori Asam Basa Bronsted Lowry dengan Teori Lewis
Teori Asam Basa Lewis berdasarkan pada Stuktur Elektron dan Sebuah Basa Lewis didefisinikan sebagai Suatu Senyawa yang bisa melepaskan Pasangan Elektron menjadi Asam dan Asam suatu Senyawa yang dapat menerima Pasangan Elektron. Gilbert Newton Lewis seorang Ilmuwan Amerika Serikat yang hidup pata tahun 1875 – 1946 ini telah membuat Teori Alternatif Reaksi Asam Basa dan Proposal Lewis ini telah memberikan penjelasan kepada Klasifikasi Teori Bronsted – Lowry dalam hal Struktur Elektron.
Namun yang jelas bahwa Teori Asam Basa Gilbert Newton Lewis ini yang paling luas dan yang paling tepat jika reaksi Asam – Basa itu melibatkan Senyawa tanpa Proton, tetapi jika yang dibahas tentang reaksi didalam Larutan Air, maka Teori Asam Basa Bronsted Lowry lah yang paling mudah digunakan karena Teori Bronsted – Lowry ini merupakan teori yang melengkapi dari kelemahan Teori Asam Basa Arrhenius yang digagas oleh Ilmuwan Kimia Svante August Arrhenius berasal dari Swedia.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...