Tekanan Osmotik Beserta Contoh Soal dan Pembahasannya
Osmosis adalah peristiwa difusi atau perpindahan pelarut dari suatu larutan lebih encer atau pelarut murni ke larutan yang lebih pekat melalui membran semi-permeable. Contoh tekanan osmotik dalam kehidupan sehari-hari adalah masuknya air tanah ke tanaman melalui sel akar. Suatu peristiwa osmosis akan menimbulkan tekanan osmotik.
TEKANAN OSMOTIK
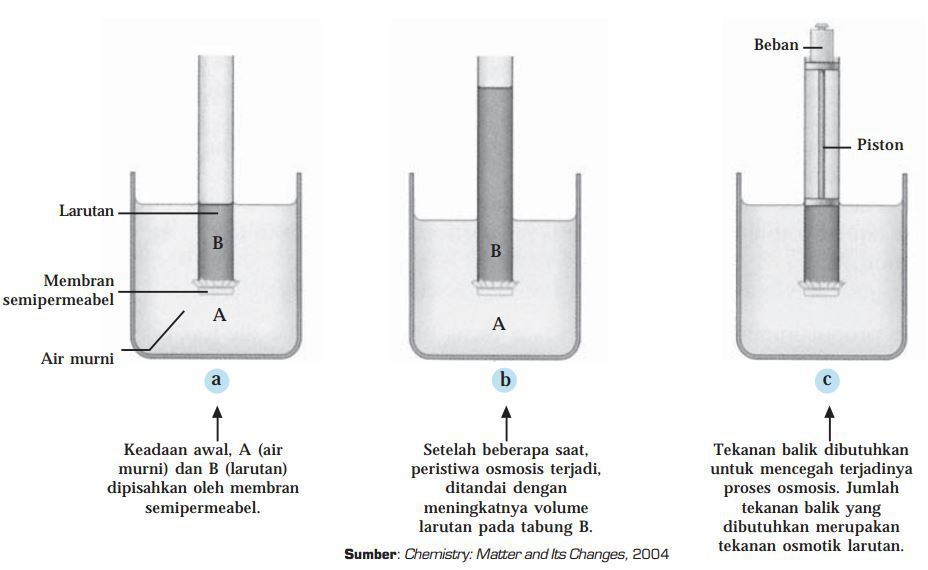
Untuk memahami tekanan osmotik lebih jauh, perhatikan gambar di bawah ini. Pada gambar tersebut ada dua wadah yang diisi air murni (A) dan suatu larutan (B). Keduanya dipisahkan oleh membran semipermeabel, dimana hanya bisa dilalui oleh molekul air saja.
Gambar (a) menggambarkan kondisi awal. Setelah beberapa lama (gambar (b)) permukaan larutan (B), menjadi naik, sedangkan permukaan air murni (B) turun, hingga kesetimbangan tercapai. Tekanan balik dibutuhkan untuk menahan terjadinya osmosis tersebut (gambar (c)) yang besarnya tentu sama dengan tekanan pada peristiwa osmosis. Inilah yang dinamakan tekanan osmotik.
Jika kondisinya tekanan osmotik antara dua larutan sama besar maka disebut isotonik. Jika tekanan osmotik salah satunya lebih besar disebut hipertonik, dan jika tekanan osmotik salah satu larutannya lebih rendah disebut hipotonik.
Jadi bisa disimpulkan:
Tekanan osmotik adalah tekanan hidrostatik yang terbentuk pada larutan untuk menghentikan proses osmosis pelarut ke dalam larutan melalui membran semi-permeabel.
Seperti yang telaah disebutkan besarnya tekanan luar (tekanan osmotik) adalah sama dengan tekanan untuk melakukan osmosis tersebut. Oleh karena itu, tekanan osmotik juga dapat didefinisikan sebagai berikut:
Tekanan osmotik adalah tekanan luar yang diberikan pada larutan untuk menghentikan proses osmosis pelarut ke dalam larutan melalui membran semi-permeabel.
Jadi secara umum, tekanan osmotik suatu larutan sama dapat berupa tekanan hidrostatis yang terbentuk dalam larutan atau tekanan luar yang diberikan pada larutan untuk menghentikan proses osmosis.
Nilai tekanan osmotik π dari suatu larutan dapat dihitung menggunakan persamaan van’t Hoff, yang identik dengan Hukum Gas Ideal.
π V = nRT
π = (n/V) R T
π = M R T
dengan π = tekanan osmotik (atm atau Pa)
V = volume larutan (L atau dm3)
n = mol zat terlarut (mol)
T = suhu
R = 0,082 L atm / mol K = 8,314 m3 Pa / mol K
Dari persamaan tersebut, terlihat bahwa nilai tekanan osmotik hanya bergantung pada jumlah partikel zat terlarut dalam larutan yang dinyatakan dengan kemolaran larutan.
Contoh Soal Tekanan Osmotik
1. Berapa tekanan osmotik suatu larutan naftalen (C10H8) dalam benzena yang mengandung 10 g naftalen per satu liter larutan? Suhu larutan 15oC.
Jawab
Jumlah mol naftalen = massa/Mr = 10/128 = 0,0781 mol
Kemolaran larutan, M = n/V = 0,0781 mol / 1 L
= 0,0781 mol/L
Tekanan osmotik,
π = 0,0781 mol/L x 0,082 L atm / mol K x 288 K = 1,85 atm
2. Berapa gr urea CO(NH2)2 yg terlrut dlm 200mL larutan agar isotonik dengan 18 gr glukosa, C2H12O6 yg terlarut dlm 500mL pd keadaan yg sama? (Ar C=12, O=16, N=14, H=1).
Jawab:
isotonik menyatakan kondisi dimana terjadi kesamaan tekanan osmotik jadi π1=π2
anggap π1 untuk larutan glukosa dan π2 untuk larutan urea. diketahui rumus tekanan osmotik yaitu :
π=MRTi namun karena urea dan glukosa bukan elektrolit maka i=1
π1=π2 ——-> M1RT = M2RT ( T dan R dianggap sama)
M1 = M2 ——> (18gr/132)/0,5 L = (xgr/60)/0,2 L ——–> x = 3,27 gr
3. Tekanan osmotik rata2 dr darah adalah 7,7 atm 25 derjt C. Berapakah konsentrasi glukosa (C6 H12 O6) akan isotonik (tekanan sama) dgn darah?
Jawab :
Hampir sama seperti pertanyaan no.1
pertama tama kita beri perumpamaan dahulu π1 = tekanan larutan glukosa π2= tekanan darah
π1=π2
MRT = 7,7 atm
xM . (0,082 L atm mol–1K–1) . 298 K = 7,7 atm
x = 0,31 M
4. Seorang pasien memerlukan larutan infus glukosa. Bila kemolaran cairan tsb 0,3 molar pada suhu tubuh 37 derajat C, tentukan tekanan osmotiknya! (R=0,082 L atm mol-1K-1)
Jawab :
π = MRT
π = 0,3 mol/L . (0,082 L atm mol–1K–1) . 310K
π = 7,62 atm
- larutan glukosa 2 M isotonik dengan larutan CH3COOH 1,5 M. Derajat ionisasi larutan asam asetat tersebut adalah ??(Kb=0,52¤C/m)
Jawab :
asam asetat termasuk elektrolit lemah sehingga rumusnya π = MRTi dimana i=(1+(n-1)α)
umpamakan π1 = tekanan os. glukosa dan π2 = tekanan os. asam asetat
π1 = π2
M1RT = M2RTi ——————– R dan T bisa dihilangkan
2 = 1,5 . (1+(n-1)α) ——— n = 2 ( merupakan jumlah ion dari ionisasi asam asetat = CH3COO- dan H+
2 = 1,5 . (1+1α) ——> 2 = 1,5 + 1,5α
α = 3
Demikian tulisan mengenai tekanan osmotik. Semoga bermanfaat…..
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...