TEORI ASAM BASA BRONSTED LOWRY
Menurut teori asam basa Bronsted Lowry , asam adalah donor proton sedangkan basa adalah akseptor proton. Nantinya akan dikenal pasangan asam basa konjugasi. Berikut penjelasan selengkapnya
TEORI ASAM BASA BRONSTED LOWRY
Penjelasan tentang asam basa Arrhenius tidak memuaskan untuk menjelaskan tentang sifat asam basa pada larutan yang bebas air atau tidak mengandung air. Sebagai contoh, asam asetat akan bersifat asam jika dilarutkan dalam air, tetapi ternyata sifat asamtersebut tidak tampak pada saat asam asetat dilarutkan dalam benzena. Demikian juga dengan larutan amonia (NH3) dalam natrium amida (NaNH2) yang menunjukan sifat basa meskipun tidak mengandung ion OH–. Berdasarkan kenyataan tersebut, Johannes Bronsted dan Thomas Lowry secara terpisah mengusulkan bahwa yang berperan dalam memberikan sifat asam dan basa suatu larutan adalah ion H+ atau proton (ingat bahwa hidrogen hanya mempunyai sebuah elektron dan sebuah proton, jika elektronnya dilepaskan menjadi ion +1, yang tertinggal hanya proton saja).
Menurut teori asam basa Bronsted Lowry , asam adalah spesi (ion atau molekul) yang berperan sebagai donor proton (pemberi proton atau H+) kepada suatu spesi yang lain. Basa adalah spesi (molekul atau ion) yang bertindak menjadi akseptor proton (penerima proton atau H+).
Atau bisa juga dikatakan bahwa menurut teori asam basa Bronsted Lowry , jika suatu asam memberi proton (H+), maka sisa asam tersebut mempunyai kemampuan menerima proton atau bertindak sebagai basa. Sisa asam tersebut dinamakan basa konjugasi dari asam semula. Demikian pula, jika suatu basa menerima proton (H+), maka basa yang terbentuk mempunyai kemampuan untuk melepas proton tersebut atau bertindak sebagai asam konjugasi dari basa semula. Secara umum pasangan asam basa konjugasi ini bisa digambarkan sebagai berikut:

Bisa disimpulkan menurut teori asam basa Bronsted Lowry
Asam adalah pemberi/ donor proton (H+)
Basa adalah penerima/ akseptor proton (H+)
Contoh 1
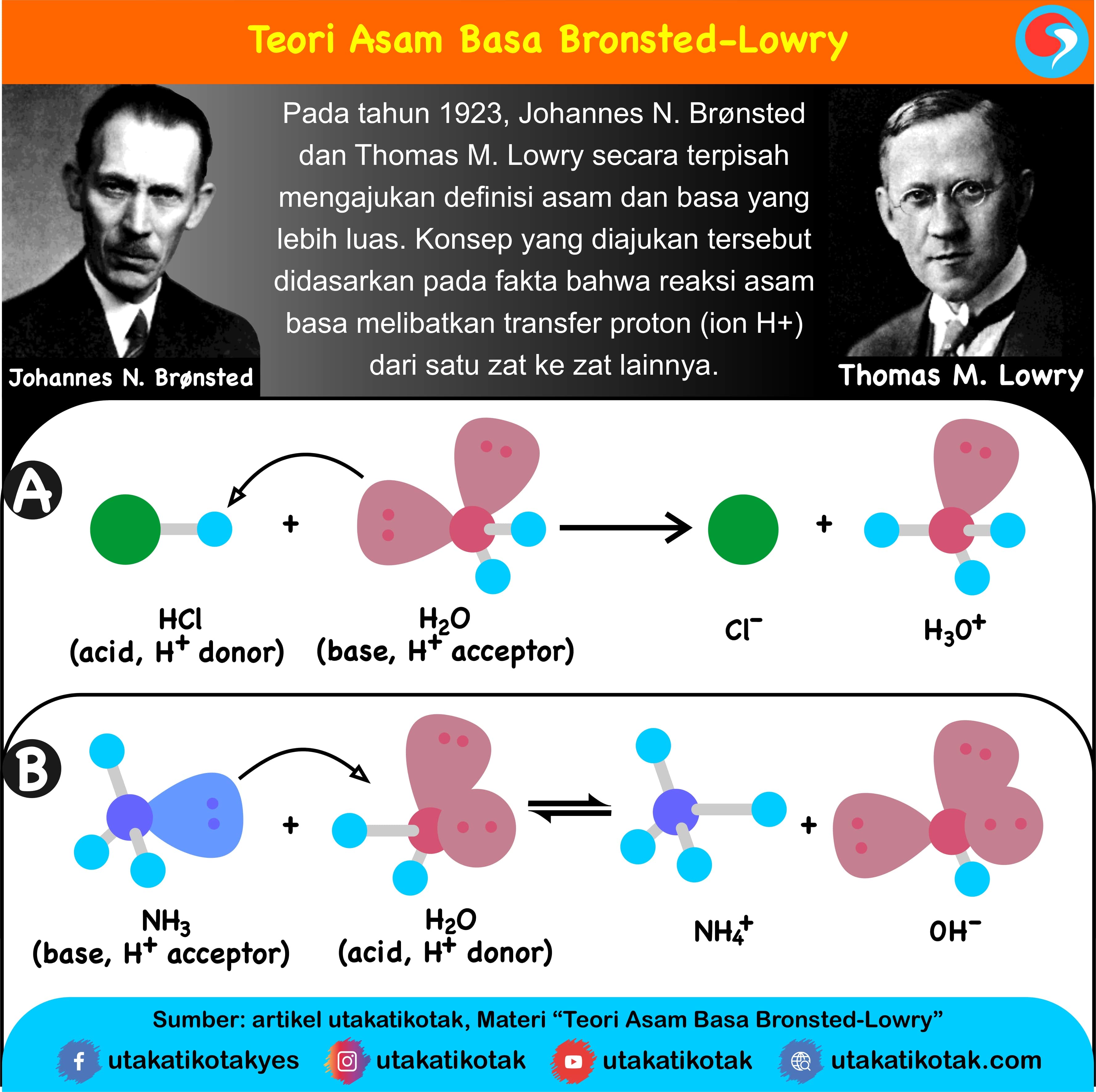
NH3(aq) + H2O(l) NH4+(aq) + OH–(aq)
Basa Asam Asam Basa
Untuk reaksi ke kanan:
H2O merupakan asam karena memberikan ion H+ (donor proton) kepada molekul NH3 untuk berubah menjadi NH4+. NH3 adalah basa karena menerima H+ (akseptor proton) dari molekul H2O.
Untuk reaksi ke kiri:
Ion NH4+ adalah asam karena memberikan ion H+ (donor proton) kepada ion OH– dan berubah menjadi molekul NH3. Sedangkan ion OH– adalah basa karena menerima ion H+ (akseptor H+) untuk berubah menjadi molekul H2O. H2O dan ion OH– adalah pasangan asam basa konjugasi, dimana ion OH– merupakan basa dari H2O dan sebaliknya H2O adalah asam konjugasi dari ion OH–.
NH3 dan NH4+ juga merupakan pasangan asam basa konjugasi, dimana NH3 adalah basa konjugasi dari NH4+ dan sebaliknya NH4+ adalah asam konjugasi dari NH3.
Contoh 2:
HCl(g) + H2O(l) H3O+(aq) + Cl–(aq)
Asam 1 Basa 2 Asam 2 Basa 1
HCl dan Cl– serta H2O dan OH– merupakan pasangan asam basa konjugasi. HCl adalah asam konjugasi dari ion Cl– dan sebaliknya Cl– merupakan basa konjugasi dari HCl.
Sifat basa dari larutan Na3PO4 dalam air juga dapat dijelaskan dengan teori asam basa Bronsted Lowry. Dalam larutan tersebut, yang menyebabkan sifat basa adalah ion PO43-.
H2O(l) + PO43-(aq) HPO42-(aq) + OH–(aq)
Asam 1 Basa 2 Asam 2 Basa 1
Demikian ulasan mengenai teori asam basa Bronsted Lowry. Semoga bermanfaat…..
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...