SIFAT ALKOHOL: Sifat Fisika Alkohol dan Sifat Kimia Alkohol (Reaksi Alkohol)
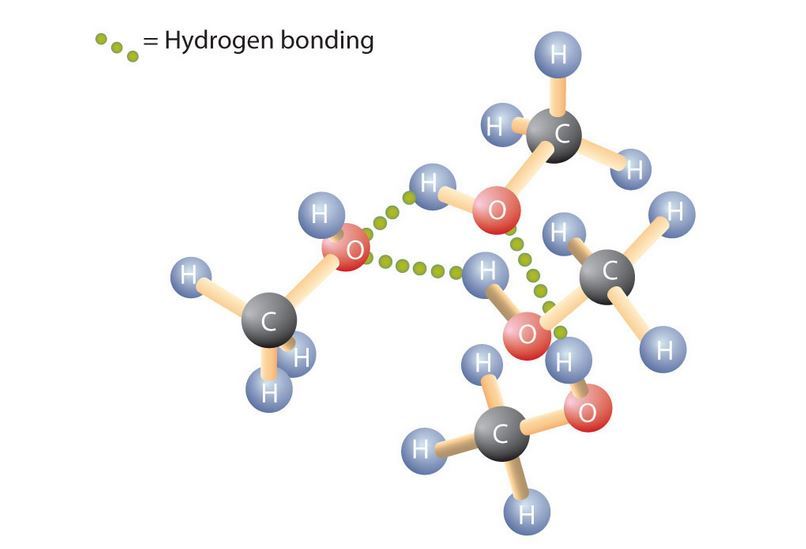
Sifat alkohol bisa dilihat dari dua aspek, sifat fisika alkohol dan sifat kimia alkohol (reaksi alkohol). Sifat fisika alkohol misalnya titik didih alkohol. Sedangkan sifat kimia alkohol membahas banyak mengenai reaksi alkohol.
A. Sifat Fisika Alkohol
1. Titik Didih Alkohol
Alkohol merupakan cairan jernih tidak berwarna dan berbau khas. Alkohol suku tinggi (jumlah atom C banyak) dan alkohol polivalen (alkohol yang memiliki banyak gugus hidroksil (-OH) dalam senyawanya) merupakan cairan kental dengan titik didih relatif tinggi.
Kebanyakan alkohol dengan jumlah atom karbon sampai dengan 11 atau 12 berwujud cair pada suhu kamar. Metanol dan etanol berupa cairan yang mudah menguap. Jenis – jenis alkohol yang lebih tinggi (butanol – dekanol) berwujud cairan kental dan beberapa isomer yang bercabang berwujud padat pada suhu kamar.
Mengapa alkohol berwujud cair dengan titik didih (td) yang lebih tinggi daripada alkana dengan berat molekul (bm) yang sama? Mengapa eter memiliki titik didih yang lebih rendah daripada alkohol pada berat molekul yang sama?
Perbedaan titik didih menunjukan bahwa interaksi antarmolekul etanol lebih kuat daripada interaksi antarmolekul dimetil eter. Etanol dan eter keduanya bersifat polar. Titik didih etanol yang lebih tinggi ini ditentukan oleh adanya ikatan hidrogen, walaupun gaya dipol – dipol juga dapat terjadi. Eter tidak memiliki gugus –OH sehingga tidak membentuk ikatan hidrogen. Ikatan antarmolekul eter adalah gaya tarik dipol – dipol . Ikatan hidrogen jauh lebih kuat daripada gaya dipol – dipol. Oleh karena itu, titik diddih dimetil eter dan dietil eter lebih 100oC lebih rendah daripada titik didih alkohol dengan berat molekul yang sama dengan kedua eter tersebut. Propana memiliki titik didih yang terendah karena propana bersifat nonpolar sehingga interaksi antarmolekul yang terjadi hanya gaya London.
Tabel perbandingan titik didih alkohol, eter, dan alkana dengan berat molekul yang sama
| Senyawa | Rumus | Berat molekul | Titik didih (oC) |
| Air | H2O | 18 | 100 |
| Etanol | CH3 CH2 – OH | 46 | 78 |
| Dimetil eter | CH3 – O – CH3 | 46 | -25 |
| Propana | CH3 CH2 CH3 | 44 | -42 |
| n-Butanol | CH3 CH2 CH2 CH2 – OH | 74 | 118 |
| Dietil eter | CH3 CH2 – O – CH2 CH3 | 74 | 35 |
| Pentana | CH3 CH2 CH2 CH2 CH3 | 72 | 36 |
2. Kelarutan
Air dan alkohol mengandung gugus –OH sehingga keduanya dapat membentuk ikatan hidrogen. Alkohol dapat larut dalam air karena membentuk ikatan hidrogen dengan air. Selain itu, antarmolekul alkohol sendiri juga membentuk ikatan hidrogen. Karena sifat alkohol adalah polar, maka alkohol menjadi pelarut yang lebih baik untuk molekul – molekul polar daripada hidrokarbon. Senyawa – senyawa seperti natrium klorida juga larut dalam alkohol.
Gugus alkil (nonpolar) pada alkohol bersifat hidrofobik (takut air). Makin panjang gugus alkilmakin rendah kelarutannya sehingga alkohol kurang larut dalam air. Oleh karena itu, alkohol juga dapat larut madlam pelarut organik nonpolar. Kelarutan alkohol dalam air berkurang dengan bertambah panjangnya rantai alkil. Sebagai contoh, kelarutan etanol lebih rendah daripada metanol, kelarutan 1-pentanol lebih rendah daripada 1-butanol.
Sifat Alkohol yang memiliki rantai pendek mudah larut dalam air pada berbagai perbandingan. Etanol jika dilarutkan dalam air akan mengalami penyusutan volume.
B. Sifat Kimia Alkohol / Reaksi Alkohol
Salah satu sifat Alkohol adalah sebagai zat amfoter, yakni dapat bertindak sebagai asam (donor proton) atau sebagai basa (akseptor proton). Sifat asam dan basa dari alkohol yang relatif sangat lemah ditunjukan oleh reaksi berikut.
1. Sebagai asam, alkohol dapat bereaksi dengan dengan larutan basa pekat (OH–) dan basa kuat seperti NH2–.
C2H5OH + OH– → C2H5O– + H2O
C2H5OH + NH2– → C2H5O– + NH3
2. Sebagai basa, alkohol dapat bereaksi dengan asamkuat seperti HBr
CH3OH + HBr → CH3OH2+ + Br–
Jenis reaksi pada alkohol tidak hanya melibatkan gugus –OH nya yang reaktif, tetapi juga kerangka karbonnya.
Sifat kimia alkohol berhubungan dengan sifat kereaktifan (dapat tidaknya bereaksi). Beberapa reaksi pada alkohol adalah sebagai berikut.
1. Reaksi Substitusi
a. Reaksi alkohol dengan logam natrium
Senyawa alkohol dan eter memiliki sifat fisis dan sifat kimia yang berbeda meskipun digolongkan sebagai pasangan isomer gugus fungsi. Untuk membedakan keduanya dapat dilihat melalui reaksinya dengan logam Na.
2CH3 CH2 OH + 2Na(s) → CH3 CH3 ONa + H2(g)
Etanol natrium etoksida
CH3 O CH3 + Na → tidak bereaksi
Dimetil eter
Alkohol akan bereaksi dengan logam natrium dan membebaskan gas hidrogen. Sementara itu, jika ke dalam eter ditambahkan natrium maka tidak akan terjadi reaksi.
b. Reaksi substitusi gugus –H oleh halogen membentuk haloalkana (R-X)
1. Reaksi alkohol dengan ion Cl– pada PCl5 atau SOCl2. Reaksi ini melibatkan pelepasan gas HCl dan digunakan sebagai reaksi identifikasi alkohol.
R – OH(l) + PCl5(l) → R – Cl(l) + POCl3(l) + HCl(g)
R – OH(l) + SOCl2(l) → R – Cl(l) + SO2(g) + HCl(g)
Selain alkohol dapat bereaksi dengan ion Cl– pada PCl5, bisa juga dengan PCl3. Perhatikan contoh berikut.
3CH3CH2OH + PCl3 → 2C2H5Cl + P(OH)3
Etanol etil klorida
2. Reaksi alkohol dengan ion I– dan Br– berlangsung dengan bantuan H2SO4 pekat.
C2H5OH(aq) + HI(l) pekat → C2H5I(l) + H2(l) (dengan bantuan H2SO4 pekat dan pemanasan)
c. Reaksi alkohol dengan Asam karboksilat (Esterifikasi)
Esterifikasi adalah reaksi antara alkoohol dengan asam karboksilat. Semua alkohol dapat bereaksi dengan asam karboksilat membentuk senyawa ester (alkil alkanoat), sedangkan eter tidak dapat bereaksi dengan asam karboksilat. Reaksi ini pertama kali dideskripsikan oleh Hermann Emil Louis Fischer dan Arthur Speier pada tahun 1895, sehingga disebut sebagai esterifikasi Fischer. Dalam reaksi ini, gugus –OH dalam asam karboksilat diganti dengan gugus –OR dari alkohol. Oleh karena itu, gugus –OR dalam ester berasal dari alkohol,s edangkan RCO- berasal dari asam karboksilat.
Contoh: CH3CH2OH + CH3COOH CH3COOH2CH3 + H2O
Metil alkohol asam etanoat etil etanoat
d. Reaksi substitusi radikal
Alkohol daat bereaksi dengan halogen (X2) melalui reaksi susbstitusi radikal dengan bantuan cahaya. Adanya cahaya memungkinkan X2 terpisah membentuk radikal bebas (X∙).
CH3OH(l) + Cl2(g) → CH2ClOH(l) + HCl(g) (dengan bantuan cahaya)
2. Reaksi Eliminasi (eliminasi air dari alkohol atau disebut dehidrasi)
a. Alkohol dapat bereaksi membentuk alkena dengan bantuan katalis H2SO4 pekat berlebih.
C2H5OH(l) → C2H4(g) + H2O(g) (dengan H2SO4 pekat berlebih, 180oC)
b. Alkohol dapat bereaksi membentuk eter
1. Reaksi pembentukan eter dengan katalis logam
Alkohol dapat bereaksi dengan logam aktif, seperti Na dan K,menghasilkan garam alkoksida dan gas hidrogen.
Alkohol + Na → Garam + H2
2R – OH + 2Na → 2R – ONa + H2
Reaksi ini identik antara asam dengan logam aktif.
Asam + logam → Garam + H2
2HCl + 2Na → 2NaCl + H2
Sebagai contoh, natrium bereaksi secara cepat dengan etanol menghasilkan gas hidrogen
CH3CH2OH + 2Na → 2CH3CH2Ona + H2
Etanol natrium etoksida
2. Alkohol berlebih dapat bereaksi membentuk eter dengan bantuan katalis H2SO4 pekat
2C2H5OH(l) → C2H5OC2H5 + H2O(l) (dengan H2SO4 pekat, 130OC)
3. Reaksi Oksidasi
Alkohol bereaksi dengan oksidator seperti K2Cr2O7 , KMnO4, dan O2 dengan bantuan katalis.
a. Oksidasi etanol oleh O2
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
b. Alkohol primer, sekunder dan tersier memberikan reaksi berbeda terhadap oksidator seperti K2Cr2O7 , KMnO4, dan O2. Dengan bantuan katalis, atom O dari oksidator akan menyerang atom H yang terikata atom C yang mengandung gugus –OH (atom C karbinol).
Alkohol Primer mudah teroksidasi membentuk halida, yang akan teroksidasi dengan cepat membentuk asam karboksilat.
CH3 CH2 CH2 CH2OH → CH3 CH2 CH2 CHO → CH3 CH2 CH2 COOH
Butanol Butanal Asam butanoat
Alkohol sekunder mudah teroksidasi membentuk alkanon
Alkohol tersier tidak mudah teroksidasi karena tidak memiliki atom H yang terikat pada atom C karbinol.
c. Fermentasi alkohol
Fermentasi alkohol adalah reaksi perubahan gula menjadi alkohol dengan bantuan miikroorganisme atau enzim tertentu. Reaksi fermentasi secara umum dapat ditunjukan sebagai berikut.
C6H12O6 → 2C2H5OH + 2CO2
Glukosa etanol
Minuman beralkohol pertama kali dibuat melalui fermentasi buah anggur. Hal tersebut dilakukan oleh negara – negara Eropa. Senyawa alkohol yang terdapat dalam minuman hasil fermentasi anggur terutama etanol. Bahan baku pembuatan etanol adalah glukosa. Ennzimuntuk mengubah glukosa menjadi etanol yaitu enzim zimase yang diproduksi oleh ragi. Glukosa dapaat diperoleh dari tetes tebu atau amilum. Tetes tebu adalah cairan gula tebu yang tidak berbentuk kristal. Tetes tebu banyak mengandung sukrosa. Sukrosa dapat dihidrolisis menghasilkan glukosa (C6H12O6). Amilum adalah polimer dari glukosa. Amilum banyak terdapat pada akar, biji, dan umbi tumbuhan. Misalnya ubi jalar, kentang dan singkong. Tanaman jagung juga mengandung amilum.
Artikel Terkait
- Introductions (Perkenalan)
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?