Pengertian Kelarutan dan Kelarutan Endapan
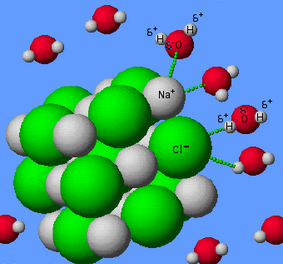
Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut. Contohnya adalah etanol di dalam air. Sifat ini lebih dalam bahasa Inggris lebih tepatnya disebut miscible.
Pengertian Kelarutan
Untuk pengertian kelarutan atau solubilitas itu sendiri adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent).
Istilah kelarutan (solubility) digunakan untuk menyatakan jumlah maksimal zat yang dapat larut dalam sejumlah tertentu pelarut. Kelarutan (khususnya untuk zat yang sukar larut) dinyatakan dalam satuan mol.L–1. Jadi, kelarutan (s) sama dengan molaritas (M).
Pelarut umumnya merupakan suatu cairan yang dapat berupa zat murni ataupun campuran. Zat yang terlarut, dapat berupa gas, cairan lain, atau padat. Kelarutan bervariasi dari selalu larut seperti etanol dalam air, hingga sulit terlarut, seperti perak klorida dalam air.
Istilah tak larut (insoluble) sering diterapkan pada senyawa yang sulit larut, walaupun sebenarnya hanya ada sangat sedikit kasus yang benar-benar tidak ada bahan yang terlarut. Dalam beberapa kondisi, titik kesetimbangan kelarutan dapat dilampaui untuk menghasilkan suatu larutan yang disebut lewat jenuh (supersaturated) yang metastabil.
Kelarutan Endapan - Pengertian Kelarutan
Banyak sekali reaksi yang digunakan dalam analisis anorganik kualitatif yang melibatkan pembentukan endapan. Endapan merupakan zat yang memisahkan diri sebagai suatu fase padat yang keluar dari larutan. Endapan mungkin berupa kristal (kristalin) atau koloid, dan dapat dikeluarkan dari larutan dengan cara penyaringan atau pemusingan (centrifuge). Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat yang bersangkutan.
Kelarutan (S) suatu endapan, menurut definisi merupakan sama dengan konsentrasi molar dari larutan jenuhnya. Kelarutan bergantung pada berbagai kondisi, seperti suhu, tekanan, konsentrasi bahan-bahan lain dalam larutan itu, dan pada komposisi pelarutnya. Perubahan kelarutan dengan tekanan, tak mempunyai arti penting yang praktis dalam analisis anorganik kualitatif, karena semua pekerjaan dilakukan dalam bejana terbuka pada tekanan atmosfer; perubahan yang sedikit dari tekanan atmosfer tak mempunyai pengaruh yang berarti atas kelarutan. Terlebih penting adalah perubahan kelarutan dengan suhu.
Umumnya dapat dikatakan, bahwa kelarutan endapan bertambah besar dengan kenaikan suhu, meskipun dalam beberapa hal yang istimewa (seperti kalium sulfat), terjadi yang sebaliknya. Laju kenaikan kelarutan dengan suhu berbeda-beda, dalam beberapa hal yang kecil sekali, dalam hal-hal lainnya sangat besar.
Pada beberapa hal perubahan kelarutan dengan berubahnya suhu dapat menjadi dasar untuk pemisahan. Misalnya, pemisahan ion timbel dari perak dan merkurium (I) dapat dicapai dengan mengendapkan ketiga ion itu mula-mula sebagai klorida, diteruskan dengan menambahkan air panas pada campuran. Air panas ini akan melarutkan timbal klorida, tetapi perak dan raksa(I) kloroda praktis tak larut dalamnya. Setelah menyaring larutan panas itu, ion timbal akan ditemukan dalam filtrat dan dapat diidentifikasikan dengan reaksi-reaksi khas.
Demikian penjelasan tentang Pengertian Kelarutan untuk materi kimia kali ini, dan semoga dapat bermanfaat dan menjadi bahan dalam membantu pengemabangan ilmu pengetahuan sains sahabat.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...