PERKEMBANGAN SISTEM PERIODIK UNSUR
Unsur-unsur yang sudah ditemukan di alam jumlahnya banyak sekali. Setiap usnur memiliki massa dan sifat yang berbeda. Namun, ada juga beberapa unsur yang memiliki kemiripan sifat. Berdasarkan hal tersebut, para ilmuwan kimia mengelompokan unsur-unsur kimia.Pengelompokan unsur-unsur kimia tersebut dikenal dengan nama Sistem Periodik. Pengelompokan unsur-unsur bertujuan memudahkan sifat setiap unsur dalam membenuk suatu senyawa.
Penyusunan sistem periodik unsur telah mengalami banyak penyempurnaan. Mulai dari Antoine Lavoisier, J. Newlands, D. Mendeleev, hingga Henry Moseley.
PERKEMBANGAN SISTEM PERIODIK UNSUR
-
Pengelompokan Unsur Menurut Lavoisier
Pada 1789, Antione Lavoisier membuat pengelompokan terhadap 33 unsur kimia. Unsur-unsur tersebut dibagi kedalam empat kelompok, yaitu tanah, gas, nonlogam, dan logam . Oleh karena pengetahuan tentang sifat-sifat unsur masih sederhana, unsur-unsur tersebut kelihatan berbeda antara yang satu dengan yang lain, artinya belum terlihat adanya kemiripan antara unsur yang satu dengan unsur yang lainnya.
Kelompok unsur gas menurut Lavoisier diantaranya ozote (nitrogen),oksigen, hidrogen, cahaya dan kalor. Kelompok unsur-unsur nonlogam diantaranyakarbon, fosfor, karbon, asam fluorida, asam klorida, dan asam borak. Sedangkan unsur-unsur logam diantaranya arsenik, bismuth, antimon, perak, tembaga, kobalt,besi, timah, raksa, mangan, emas, molibdenum, nikel, timbal, platina, seng, dan tungsten. Adapun kelompok unsur tanah diantaranya kapur, barium oksida, magnesium oksida, silikon oksida, dan aluminium oksida.
-
Hukum Triade Dobereiner
Pada 1829, J.W. Dobereiner mengelompokan unsur-unsur berdasarkan kemiripan sifat-sifatnya. Unsur pembentuk garam dan massa atomnya, yaitu Cl = 35,5, Br = 80, dan I = 127. Unsur pembentuk alkali dan massa atomnya, yaitu Li=7, Na=23, dan K=39. Unsur pembentuk alkali tanah dan massa atomnya, yaitu Ca=40, Sr=88, dan Ba=136.
Dari pengelompokan unsur-unsur tersebut, terdapat suatu keteraturan. Setiap tiga unsur yang sifatnya mirip, massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur yang pertama dan ketiga. Perhatikan contoh berikut.
Ar Na = (Ar Li + Ar K) / 2 = (7+39) / 2 = 46 / 2 = 23
Contoh lain

-
Sistem Periodik Oktaf Newlands
J. Newlands merupakan orang pertama yang mengelompokan unsur-unsur berdasarkan kenaikan massa atom relatif. Pada 1863, ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Jadi, jika diurutkan

Sistem periodik unsur Newlands
-
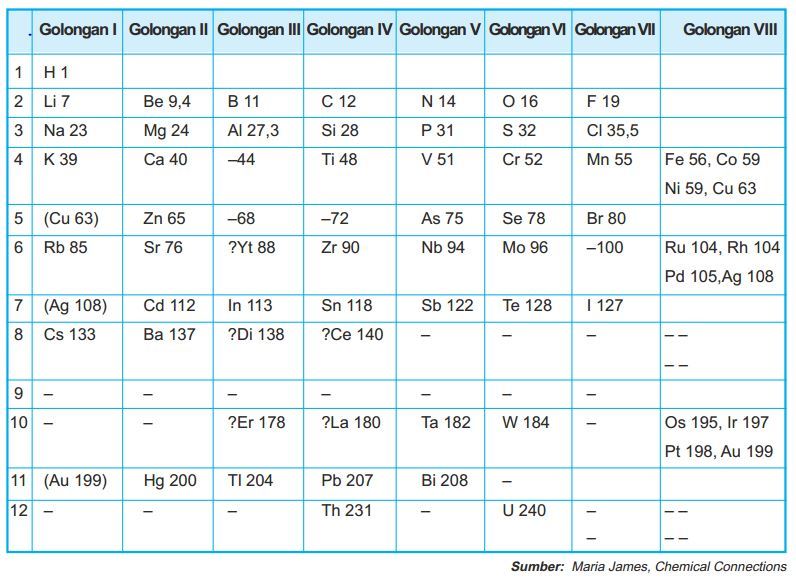
Sistem Periodik Mendeleev
Salah satu ahli kimia yang terbilang sukses dalam pengelompokan unsur-unsur adalah Dmitri Ivanovich Mendeleev, sarjana asal Rusia. Mendeleev berani memprediksi unsur-unsur yang belum ditemukan kala itu. Dasar dari pengelompokan unsur-unsur versi Mendeleev adalah berdasarkan kenaikan massa atom relatifnya.
Uniknya, Mendeleev mengelompokan unsur-unsur tersebut dengan menggunakan kartu, dimana setiap kartu tersebut tertulis lambang unsur, sifat-sifat unsur dan massa atom relatifnya. Unsur-unsur tersebut disusun berdasarkan sifat-sifat unsur dan kenaikan massa atom relatifnya. Namun, pengelompokan ini menekankan sifat-sifat kimia unsur ketimbang massa atomnya.

Sistem periodik unsur Mendeleev
Unsur-unsur yang memiliki kesamaan sifat ditempatkan pada lajur vertikal yang dinamakan golongan. Demi menetapkan kemiripan sifatnya ini,Mendeleev mengosongkan beberapa tempat di sistem periodiknya, sebagai contoh menempatkan Ti (Ar=48) pada golongan IV dan membiarkan golongan III kosong, karena Ti lebih mirip dengan C dan Si, daripada dengan B dan Al.
Pada waktu yang hampi bersamaan, Lothar Meyer melakukan hal yang mirip dengan Mendeleev. Ilmuwan kimia Jerman tersebut menyusun 57 unsur kimia berdasarkan kenaikan massa tom. Hal yang membedakan dengan Mendeleev, Meyer mengelompokannya dengan menekankan pada sifat fisik unsur. Adapun Mendeleev, berdasarkan sifat kimia unsur. Sistem periodik Meyer tersebut disusun pada 1868, namun baru dipublikasikan pada 1870.
-
Sistem Periodik Modern
Pada 1913, seorang kimiawan Inggris bernama Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar X.
Berdasarkan eksperimennya tersebut, diperoleh kesimpulan bahwa sifat atom bukan didasari oleh massa atom relatif, melainkan berdasarkan kenaikan jumlah proton. Hal tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi, memiliki jumlah proton sama atau disebut isotop.

Sistem periodik unsur Modern
Kenaikan jumlah proton ini mencerminkan kenaikan nomor atom unsur tersebut. Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang disebut juga sistem periodik bentuk panjang.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...