PENURUNAN TITIK BEKU
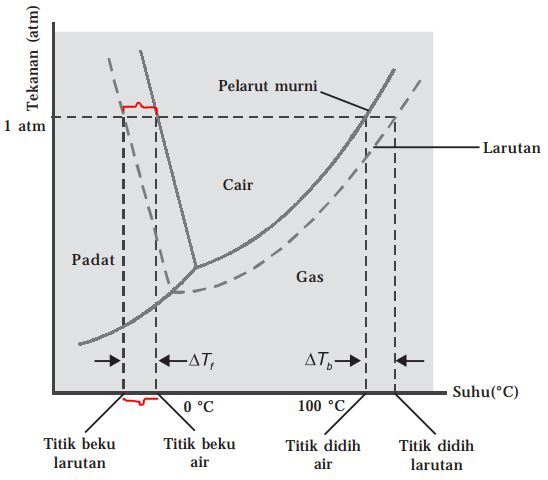
Apabila ke dalam air ditambahkan zat terlarut maka titik beku larutan akan turun. Atau dengan kata lain, terjadi peristiwa penurunan titik beku larutan. Simak penjelasan selengkaapnya.
PENURUNAN TITIK BEKU (Tf)
1. Titik Beku (Tf)
Apakah sobat pernah memegang es batu? Tentu sudahkan, pertanyaan konyol hehe. Tapi dapatkah sobat menjelaskan bagaimana proses perubahan air menjadi es? Benar, air berubah menjadi es melalui proses pembekuan, hehe. Namun pertanyaan berikutnya, kapan mulai terjadinya proses pembekuan?
Suatu zat mengalami proses pembekuan jika telah mencapai titik beku. Titik beku (Tf) akan tercapai apabila temperatur saat tekanan uap zat padat sama dengan tekanan uap zat cair. Apabila sobat mengetahui bahwa titik beku air sebesar 0oC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0oC sama dengan tekanan uap air dalam bentuk padat. Temperatur yaang diperoleh saat zat cair dan zat padat berada pada kesetimbangan (pada 760 mmHg) disebut dengan titik beku normal. Oh iya jangan heran kalau ada perbedaan mengenai simbol titik beku, ada yang Tf dan ada yang Tb. Disini simbol titik beku yang dipakai adalah Tf dari ‘freezing’ ya, kalo versi bahasa Indonesia yaitu Tb dari ‘beku’.
2. Penurunan Titik Beku Larutan
Apabila ke dalam sebuah zat pelarut ditambahkan zat terlarut maka akaan terjadi proses penurunan tekanan uap jenuh larutan. Adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dengan kata lain, larutan akan membeku pada temperatur yang lebih rendah.
Berdasarkan penjalasan di atas, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut dengan titik beku larutan. Besarnya penurunan titik beku larutan diberi lambang ∆Tf. Harga ∆Tf ditentukan oleh banyaknya partikel zat terlarut dan tidak ditentukan oleh sifat zat terlarutnya. Nilai ∆Tf ditentukan berdasarkan rumus Bekmann dan Roult seperti berikut ini.
∆Tf = Tf(pelarut) – Tf(larutan)
∆Tf = m . Kf
Dengan, ∆Tf = penurunan titik beku (freezing point depression)
m = molalitas
Kf = tetapan penurunan titik beku (oC kg/mol)
Sebagai acuan dan perbandingan untuk sobat dalam melakukan pengamatan ataupun perhitungan, berikut diberikan dataa tentang titik beku dan nilai Kf beberapa pelarut.
Nilai Kf beberapa pelarut
| Pelarut | Rumus Molekul | Titik Beku (oC) pada 1 atm | Kf(oC/m) |
| Air | H2O | 0 | 1,86 |
| Asam cuka | CH3COOH | 16,5 | 3,82 |
| Benzena | C6H6 | 5,5 | 5,12 |
| Fenol | C6H5OH | 40 | 7,3 |
| Kamfer | C10H6O | 180 | 40 |
| Nitrobenzena | C6H5NO2 | 5,6 | 6,9 |
| Kloroform | CHCl3 | 63,5 | 4,68 |
Baca Juga :
PENURUNAN TITIK BEKU LARUTAN DAN APLIKASINYA
Air Panas Lebih Cepat Beku ketimbang Air Dingin, Benarkah?
Titik didih melibatkan lebih dari satu fase kondisi atau fase zat terkait (fase cair-gas). Oleh karena itu, kenaikan titik didih akibat penurunan tekanan uap, dapat dijelaskan diagram fase.
Untuk lebih memantapkan pemahaman sobat, sekarang coba perhatikan contoh soal berikut.
Contoh Soal Penurunan Titik Beku
Jika 50gram zat anti beku etilen glikol (C4H4(OH)2) dilarutkan ke dalaam 100 gram air, berapakah titik beku larutan jika Tf air 0oC? (Mr C4H4(OH)2 =62; Kf air = 1,86 oC kg/mol)
Jawab:
Mol C4H4(OH)2 = massa/Mr = 50/62 = 0,806 mol
Kemolalan, m = n/kgpelarut = 0,806 / 0,1 = 8,06 mol/kg
Penurunan titik beku larutan,
∆Tf = m . Kf = 1,86 . 8,06 = 15oC
Titik beku larutan, Tf= 0oC – 15oC = – 15oC
Demikian tulisan mengenai penurunan titik beku larutan.Semoga bermanfaat…..
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...