PENURUNAN TITIK BEKU LARUTAN DAN APLIKASINYA
Penurunan titik beku sebenarnya sudah banyak diaplikasikan di kehidupan sehari – hari oleh kita, meskipun tanpa disadari. Berikut akan dibahas konsep penurunan titik beku larutan dan juga rumusnya.
Konsep Penurunan Titik Beku Larutan
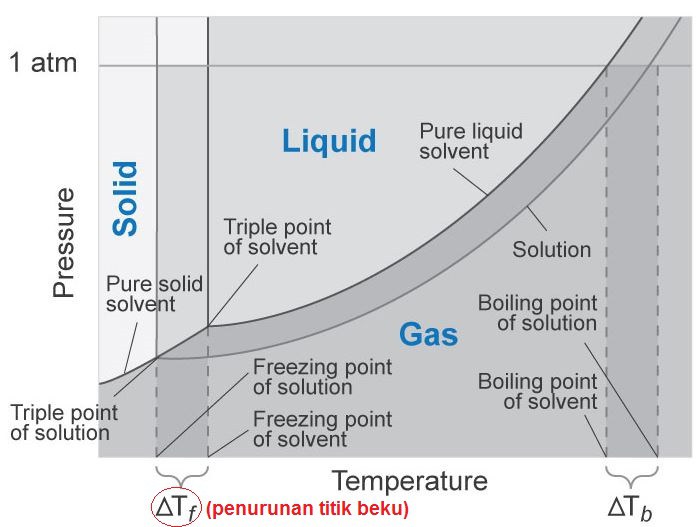
Titik beku adalah suhu pada nilai tekanan tertentu, saat terjadi perubahan wujud dari cair menjadi padat. Dari diagram fasa tersebut terlihat bahwa adanya zat terlarut menyebabkan titik beku larutan lebih rendah daripada titik beku pelarut murninya. Hal ini terjadi karena, pada umumnya zat terlarut lebih suka berada fasa cair dibandingkan fasa padat, akibatnya pada saat proses pendinginan berlangsung larutan akan mempertahankan fasanya dalam keadaan cair. Oleh karena itu, dibutuhkan suhu yang lebih rendah (dari titik beku pelarutnya) agar larutan tersebut dapat membeku seluruhnya. Selisih antara titik beku pelarut dan titik beku larutan disebut penurunan titik beku larutan (∆Tf). Penurunan titik beku merupakan salah satu sifat koligatif larutan. Sifat koligatif larutan merupakan sifat suuat zat yang tidak tergantung dari jenis zat, tetapi tergantung dari jumlah zat. Penurunan titik beku dapat dihitung dari selisih titik beku pelarut terhadap titik beku larutan, berikut rumusnya
∆Tf = titik beku pelarut – titik beku larutan
Pada gambar di bawah terlihat bahwa garis pelarut murni dapat dipandang sebagai batas terendah dari konsentrasi larutan. Titik beku semakin ke kiri semakin rendah, konsentrasi larutan semakin besar. Dari diagram tersebut dapat diketahui bahwa penurunan titik beku larutan berbanding lurus dengan kemolalan larutan.

Hubungan antara penurunan titik beku larutan nonelektrolit dan kemolalan larutan diberikan dalam persamaan berikut.
∆Tf = m · Kf
atau
∆Tf = Kf x x
keterangan: ∆Tf = penurunan titik beku larutan (oC)
Kf = tetapan (konstanta) penurunan titik beku molal pelarut (oC/m)
m = kemolalan (m)
g = massa zat terlarut (g)
Mr = massa molekul relative zat terlarut
p = massa pelarut (g)
Sedangkan untuk larutan elektrolit harus memperhitungkan jumlah ion yang dihasilkan yang dikenal sebagai faktor van’t hoff. Faktor van’t hoff adalah faktor yang membandingkan jumlah ion dari larutan elektrolit terhadap jumlah molekul dari larutan nonelektrolit. Pengaruh faktor van’t hoff ini dapat di rumuskan sebagai berikut.
∆Tf = m x Kf x i
dengan i = {1 + (n-1) α }
n = jumlah koefisien kation dan anion
α = derajat ionisasi elektrolit
Aplikasi penurunan titik beku
1. Digunakan dalam pembuatan cairan pendingin
Cairan pendingin adalah larutan berair yang memiliki titik beku jauh dibawah 00 C. Dibuat dengan melarutkan berbagai jenis garam ke dalam air.
2. Digunakan dalam pembuatan cairan antibeku
Antibeku adalah zat yang ditambahkan ke dalam suatu cairan untuk menurunkan titik bekunya. Digunakan untuk mencegah pembekuan cairan pendingin
3. Pencairan salju di jalan raya
Demikian tulisan mengenai penurunan titik beku larutan dan aplikasinya, semoga bermanfaat.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...