PENGERTIAN KONSEP MOL DALAM KIMIA
Bagaimana cara Anda menghitung jumlah yang sangat besar dari partikel-partikel materi yang berukuran sangat kecil tersebut?
PENGERTIAN KONSEP MOL
Untuk menyederhanakan jumlah partikel yang luar biasa kecilnya ini digunakan konsep mol. Mol menyatakan satuan jumlah zat. Satuan jumlah zat ini sama halnya dengan penyederhanaan jumlah suatu barang. Contoh,1 lusin digunakan untuk menyederhanakan 12 satuan barang pecah belah dan 1 rim untuk menyatakan 500 lembar kertas. Penyederhanaan ini perlu dilakukan karena proses kimia yang berlangsung dalam kehidupan sehari-hari melibatkan sekumpulan partikel sangat kecil yang jumlahnya sangat besar. Satuan partikel-partikel tersebut terlampau sulit untuk diamati.
1 mol = L partikel
L =Bilangan Avogadro = 6,02 x 1023
Jadi, konsep mol adalah satuan jumlah zat yang menyatakan banyaknya partikel zat itu.
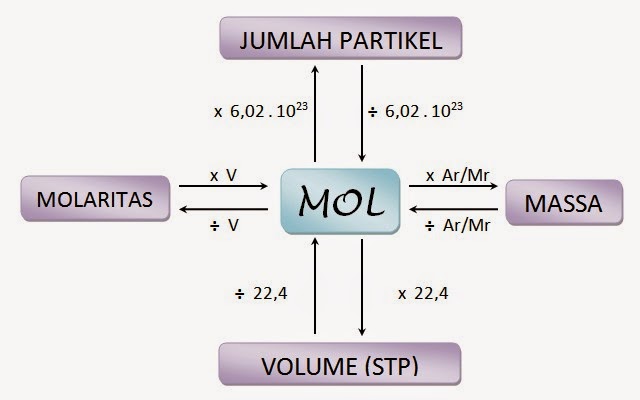
RUMUS KONSEP MOL
Dengan demikian, 1 mol zat mengandung 6,02 x 1023 partikel. Hubungan antara jumlah mol dan jumlah partikel dapat dirumuskan sebagai berikut:
Jumlah mol X (n) = jumlah partikel X/ L
atau
Jumlah partikel X = n x L
Bilangan Avogadro (L) ditemukan oleh Johann Loschmidt pada 1865. Nama Avogadro dipilih sebagai penghormatan kepada Avogadro karena beliau orang pertama yang mengusulkan perlunya satuan jumlah partikel. Adapun nama Loschmidt diabadikan sebagai simbol bilangan tersebut, L.
Nilai bilangan Avogadro adalah L = 6,02 x 1023. Dapatkah Anda bayangkan besarnya angka tersebut? Seandainya dikumpulkan sebanyak 6,02 x 1023 butir beras, beras itu dapat ditimbunkan pada permukaan benua Australia dengan ketinggian mencapai satu kilometer! Atau, jika dimisalkan atom sebesar kelereng dan disebarkan di permukaan bumi, seluruh permukaan bumi akan tertutup kelereng dengan ketebalan lapisan 80 km! Bilangan yang luar biasa besarnya ini dipilih untuk menyatakan jumlah atom karena kepraktisan dan ketepatannya. Bayangkan,alangkah rumitnya jika jumlah atom dinyatakan dalam satuan butir, lusin, gros, kodi, atau satuan lainnya.
Bilangan Avogadro bersifat istimewa karena menguhungkan satuan gram dengan sma. Contoh, sebanyak 6,02 x 1023 atom C-12 memiliki massa sebesar 12 gram. Anda perhatikan, angka 12 gram setara dengan massa atom realtif C-12 yakni 12 sma. Inilah inti dari konsep mol yang diusulkan oleh Avogadro.
Berikut ini contoh penggunaan bilangan Avogadro dalam perhitungan kimia.
CONTOH SOAL KONSEP MOL
CONTOH SOAL KONSEP MOL 1
Reaksi pembakaran yang sempurna menghasilkan gas karbon dioksida (CO2). Jika dalam satu hari sebuah bus rata-rata melepaskan 1 mol CO2 dalam emisi gas buangnya, berapa jumlah atom dari CO2 yang dilepaskan bus tersebut selama seminggu?
Penyelesaian:
Jumlah mol CO2 = 1 mol/hari x 7 hari = 7 mol
Jumlah atom dalam satu molekul CO2 = 1 atom C + 2 atom O = 3 atom
Jumlah Molekul CO2 = 7 x 6,02 x 1023 molekul = 42,14 x 1023 molekul
Jadi, jumlah atom dari CO2yang dilepaskan = 42,14 x 1023 molekul x 3 atom/molekul = 1,26 x 1025atom
CONTOH SOAL KONSEP MOL 2
Berapa jumlah mol natrium yang terdapat dalam 6,02 x 1024 atom Na?
Penyelesaian:
Jumlah mol Na = Jumlah partikel / L = 6,02 x 1024 molekul / 6,02 x 1023 molekul mol-1= 10 mol
Jadi, 6,02 x 1024 atom Na = 10 mol.
CONTOH SOAL KONSEP MOL 3
Berapa jumlah mol ammonia yang terdapat dalam 3,01 x 1026 molekul NH3?
Penyelesaian
Jumlah mol NH3 = 3,01 x 1026 molekul / 6,02 x 1023 molekul mol-1 = 500 mol
Jadi, 3,01 x 1026 molekul NH3 = 500 mol
Demikian tulisan mengenai konsepmol. Jika ada masukan, saran, ataupun pertanyaan silahkan berkomentar ya. Semoga bermanfaat….
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...