IKATAN ION
Pengertian Ikatan Ion
Ikatan ion adalah ikatan yang terjadi akibat adanya serah terima elektron sehingga membentuk ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia. Ion positif dan ion negatif diikat oleh suatu gaya elektrostatik. Senyawa yang dihasilkan disebut senyawa ion.
Salah satu contoh ikatan ion yang sering kita jumpai sehari-hari adalah garam dapur. Ya, garam dapur rumus kimianya NaCl (Natrium klorida). Dalam NaCl padat terdapat ikatan antara ion Na+ dan ion Cl– dengan gaya elektrostatik sehingga disebut ikatan ion. Bentuk kristal NaCl merupakan rangkaian antara ion Na+ dan ion Cl–. Satu ion Na+ dikelilingi oleh enam ion Cl– dan satu ion Cl– dikelilingi oleh enam ion Na+ seperti yang diilustrasikan oleh gambar di bawah.

Struktur NaCl
1 Cl dikelilingi 6 Na dan sebaliknya 1 Na dikelilingi 6 Cl
Pembentukan ikatan ion
Seperti yang telah dibahas pada kaidah oktet sebelumnya, bahwa supaya stabil, setiap unsur harus berusaha memiliki konfigurasi elektron seperti gas mulia, bisa dengan melepaskan elektron ataupun menerima elektron.
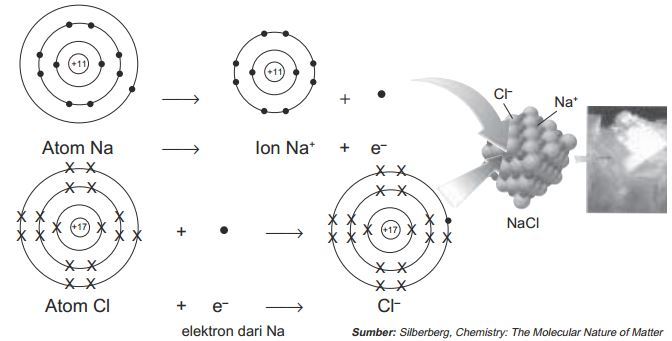
Peristiwa serah terima elektron ini terjadi pada senyawa NaCl alias garam dapur. Bagaimana ceritanya? Na merupakan golongan IA dimana ia memiliki elektron valensi 1, sehingga supaya stabil ia harus melepas 1 elektron. Kalo dilihat dari konfigurasi elektronnya, 11Na: 2, 8, 1. Sehingga ketika melepas 1 elektron, maka elektron paling terakhinya menjadi 8 (sesuai kaidah oktet). Karena melepas 1 elektron, maka Na yang asalnya netral berubah menjadi bermuatan +1 (Na+). Reaksinya:
Na → Na+ + e– (artinya Na melepas 1 elektron, lihat elektron berada di sebelah kiri panah)
Oke, sekarang kira-kira kemana tuh 1 elektron tadi yang dilepas Na? hilang kah? Tidak, disana ada yang menangkapnya yaitu si Cl. Kenapa bisa? Karena Cl memiliki elektron valensi 7 (dia golongan VIIA). Ya kalo dilihat dari konfigurasi elektronnya 17Cl : 2, 8, 7. Jadi kalo Cl menangkap 1 elektron, konfigurasinya menjadi 2, 8, 8, dengan elektron terakhirnya 8, ini sudah mematuhi kaidah oktet. Karena Cl menangkap 1 elektron maka Cl yang asalnya netral berubah menjadi -1 (Cl–). Reaksinya:
Cl + e– → Cl– (artinya Cl menerima 1 elektron, lihat elektron berada di sebelah kiri panah)
Nah sekarang, apa pengaruhnya pembentukan Na+ dan Cl– ini? Sesuai hukum Coulomb, muatan yang berbeda jenis akan saling tarik menarik. Sehingga Na+ ini akan berikatan dengan Cl– dengan gaya elektrostatik.
Na+ + Cl– → NaCl
Untuk lebih jelasnya perhatikan gambar berikut:

Proses pembentukan ikatan ion pada NaCl
Kira-kira unsur apa saja yang bisa membentuk ikatan ion? Jawabnya ada di ujung langit, kita kesana dengan seorang anak, anak yang tangkas dan juga pemberani, haha… maaf nih kali ini agak lebay.
Ikatan ion = logam + nonlogam
Kalo digeneralisir, ikatan logam itu diantaranya Golongan IA (kecuali H), IIA (kecuali Be), IIIA (Aluminium), golongan transisi (Golongan B). Sedangkan nonlogam, diantaranya golongan IVA-VIIA, kalo VIIIA relatif stabil.
Contoh:
- K2O memiliki ikatan ionik,karena K termasuk logam (golongan IA) dan O termasuk nonlogam (golongan VIA)
- CH4 tidak memiliki ikatan ionik, karena C termasuk nonlogam (golongan IVA) dan H juga nonlogam (golongan IA, tetapi untuk H sifatnya kovalen)
- KF memiliki ikatan ionik, karena K termasuk logam (golongan IA) dan F termasuk nonlogam (golongan VIIA).
Nah begitulah sekelumit tentang ikatan ion.Semoga bermanfaat
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...