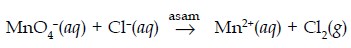Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron

Berikut merupakan cara penyetaraan reaksi redoks dengan Cara Setengah Reaksi atau yang biasa disebut dengan ion elektron. Penyetaraan persamaan reaksi redoks dengan cara ini dilakukan dengan membagi reaksi menjadi 2 bagian, yaitu:
a. sistem yang teroksidasi;
b. sistem yang tereduksi.
Penyelesaian dilakukan untuk setiap bagian, dilanjutkan dengan penyetaraan jumlah elektron yang terlibat pada bagian a dan b, yang diakhiri dengan menjumlahkan kedua reaksi
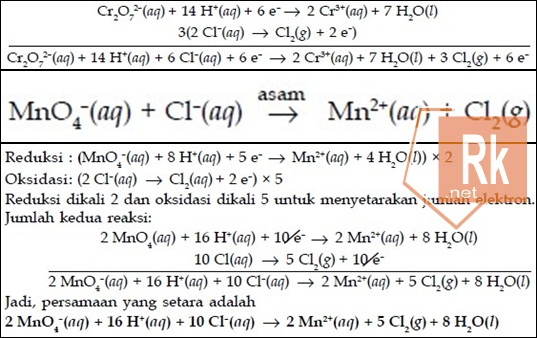 |
Langkah-langkah Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron
Misalkan ada pertanyaan seperti berikut ini:
Setarakan persamaan untuk reaksi natrium dikromat (Na2Cr2O7) dan asam klorida untuk menghasilkan natrium klorida, kromium(III) klorida, air, dan klorin!
Cara menjawabnya:
Langkah 1
natrium dikromat + asam klorida → natrium klorida + kromium (III) klorida + air + klorin
Langkah 2
Na2Cr2O7(aq) + HCl(aq) → NaCl(aq) + CrCl3(aq) + H2O(l) + Cl2(g) (tidak setara)
Langkah 3
Tuliskan bentuk ion setiap zat, baik untuk persamaan reduksi maupun untuk oksidasi.
Untuk persamaan reduksi:
Cr2O72–(aq) → 2 Cr3+(aq) (belum lengkap)
Dengan mengetahui bahwa oksigen akan membentuk air, diperoleh
Cr2O72–(aq)→ 2 Cr3+(aq) + 7 H2O(l) (belum lengkap)
Juga mengetahui bahwa ion hidrogen harus bergabung dengan oksigen untuk membentuk air, maka diperoleh
Cr2O72–(aq) + 14 H+(aq)→ 2 Cr3+(aq) + 7 H2O(l) (setara)
Dengan menambahkan elektron secukupnya pada ruas kiri untuk menyetarakan muatan maka persamaan menjadi:
Cr2O72–(aq) + 14 H+(aq) + 6 e–→ 2 Cr3+(aq) + 7 H2O(l)
Untuk persamaan oksidasi:
2 Cl–(aq) → Cl2(g) (setara)
Sebanyak 2 e– harus ditambahkan di ruas kanan agar muatannya menjadi setara
2 Cl–(aq) → Cl2(g) + 2 e–
Langkah 4
Selanjutnya kedua reaksi reduksi dan oksidasi dijumlahkan:
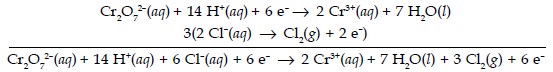
Persamaan kedua dikalikan 3 sehingga jumlah elektron yang dilepaskan dalam oksidasi sama dengan elektron yang diterima dalam reduksi (elektron saling menghabiskan).
Cr2O72–(aq) + 14 H+(aq) + 6 Cl–(aq) → 2 Cr3+(aq) + 7 H2O(l) + 3 Cl2(g)
Langkah 5
Untuk menuliskan persamaan keseluruhan yang setara, dikembalikan ke persamaan reaksi molekul dengan memasukkan 2 ion Na+ untuk setiap Cr2O72– dan satu Cl– untuk setiap H+. Persamaan akhir adalah
Na2Cr2O7(aq) + 14 HCl(aq) → 2 NaCl(aq) + 2 CrCl3(aq) + 7 H2O(l) + 3 Cl2(g)
Jadi, persamaan yang setara adalah
Na2Cr2O7(aq) + 14 HCl(aq) → 2 NaCl(aq) + 2 CrCl3(aq) + 7 H2O(l) + 3 Cl2(g)
Contoh Soal dan Penyelesaian Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi
1. Setarakan persamaan reaksi berikut:
Jawab:
MnO4–(aq) → Mn2+(aq) (reduksi)
Cl–(aq) → Cl2 (g) (oksidasi)
Menyetarakan jumlah atom O dilakukan dengan penambahan H2O jika suasana reaksi asam. Jumlah H dari H2O yang ditambahkan disetarakan dengan penambahan H+ di ruas lain. Jika suasana reaksi basa menyetarakan jumlah atom O dilakukan dengan penambahan OH– di ruas lain. Jumlah H+ dan OH– yang ditambahkan disetarakan dengan penambahan H2O di ruas lainnya.

Nah itulah penjelasan mengenai Cara Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi atau Ion Elektron Semoga Bermanfaat ..!!
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...