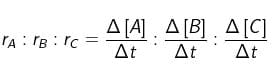Contoh-Contoh Laju Reaksi Kimia

Laju reaksi merupakan laju penurunan reaktan (pereaksi) atau laju bertambahnya produk (hasil reaksi).
Laju reaksi ini juga menggambarkan cepat lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan proses mengubah suatu zat (pereaksi) menjadi zat baru yang disebut dengan produk.
Nonton Video Kita : Faktor-Faktor Yang Mempengaruhi Laju Reaksi
Beberapa reaksi kimia ada yang berlangsung cepat. Natrium yang dimasukkan ke dalam air akan menunjukkan reaksi hebat dan sangat cepat, begitu pula dengan petasan dan kembang api yang disulut. Bensin akan terbakar lebih cepat daripada minyak tanah. Namun, ada pula reaksi yang berjalan lambat. Proses pengaratan besi, misalnya, membutuhkan waktu sangat lama sehingga laju reaksinya lambat.
"Cepat lambatnya proses reaksi kimia yang berlangsung dinyatakan dengan laju reaksi."
Dalam mempelajari laju reaksi digunakan besaran konsentrasi tiap satuan waktu yang dinyatakan dengan molaritas. Apakah yang dimaksud molaritas? Simak uraian berikut.
Baca juga: Apa saja Faktor-faktor yang Mempengaruhi Laju Reaksi beserta Penjelasan Singkatnya?
Molaritas sebagai Satuan Konsentrasi dalam Laju Reaksi
Molaritas menyatakan jumlah mol zat dalam 1 L larutan, sehingga molaritas yang dinotasikan dengan M, dan dirumuskan sebagai berikut.
M = n/V
Keterangan :
n = jumlah mol dalam satuan mol atau mmol
V = volume dalam satuan L atau mL
Manfaat Laju Reaksi dalam Kehidupan Sehari-hari
Dengan mempelajari laju reaksi kita dapat mengetahui bahwa reaksi itu dapat berlangsung dipengaruhi oleh beberapa faktor, misalnya saja luas permukaan. Jika kita mengetahui bahwa luas permukaan itu mempengaruhi laju reaksi, pasti kita akan memperkecil luas permukaan suatu zat sebelum mengolahnya.
Beberapa contoh penerapan Laju Reaksi dalam kehidupan sehari hari :
-
Ibu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
-
Penduduk pedesaan membelah kayu gelondongan menjadi beberapa bagian sebelum dimasukkan ke dalam tungku perapian.
-
Penjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahan lain.
-
Dalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
-
Bahan baku yang sering di tambang, tersedia dalam bentuk butir-butiran kasar. Untuk mempercepat pengolahan selanjutnya, butiran-butiran tersebut dihancurkan sampai halus.
-
Dalam pembuatan roti kita bisa menambahkan ragi yang berfungsi sebagai katalis untuk mempercepat laju reaksinya.
Faktor Laju Reaksi
Faktor-faktor yang mempengaruhinya antara lain:
-
1. Konsentrasi Reaktan
Semakin tinggi konsentrasi reaktan, semakin banyak jumlah partikel reaktan yang bertumbukan, sehingga semakin tinggi frekuensi terjadinya tumbukan dan lajunya meningkat. Sebagai contoh, dalam reaksi korosi besi di udara, laju reaksi korosi besi lebih tinggi pada udara yang kelembabannya lebih tinggi (konsentrasi reaktan H2O tinggi)
-
2. Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu pada suatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.
-
3. Tekanan
Banyak reaksi yang melibatkan pereaksi dalam wujud gas. Kelajuan dari pereaksi seperti itu juga dipengaruhi tekanan. Penambahan tekanan dengan memperkecil volume akan memperbesar konsentrasi, dengan demikian dapat memperbesar laju reaksi.
-
4. Keberadaan Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
-
5. Luas Permukaan Sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam laju reaksi, sebab semakin besar luas permukaan bidang sentuh antar partikel, maka tumbukan yang terjadi semakin banyak, sehingga menyebabkan laju reaksi semakin cepat.
Begitu juga, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil. Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.
Baca Juga :
Perubahan Entalpi Reaksi Termokimia Beserta Contoh dan Pembahasannya
Rumus Laju Reaksi
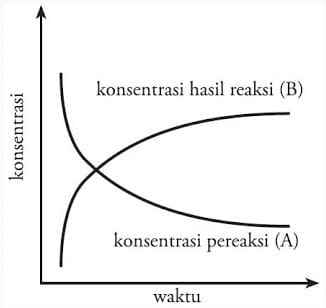
Laju reaksi kimia bukan hanya sebuah teori, namun dapat dirumuskan secara matematis untuk memudahkan pembelajaran. Pada reaksi kimia: A → B, maka laju berubahnya zat A menjadi zat B ditentukan dari jumlah zat A yang bereaksi atau jumlah zat B yang terbentuk per satuan waktu. Pada saat pereaksi (A) berkurang, hasil reaksi (B) akan bertambah. Perhatikan diagram perubahan konsentrasi pereaksi dan hasil reaksi pada Gambar 3.
Diagram perubahan konsentrasi pereaksi dan hasil reaksi.
Berdasarkan gambar tersebut, maka rumusan laju reaksi dapat kita definisikan sebagai:
a. berkurangnya jumlah pereaksi (konsentrasi pereaksi) per satuan waktu, atau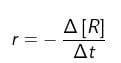 , dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah :
, dengan r = laju reaksi, – d[R] = berkurangnya reaktan (pereaksi), dan dt = perubahan waktu. Untuk reaksi : A → B, laju berkurangnya zat A adalah : 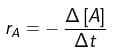
b. bertambahnya jumlah produk (konsentrasi produk) per satuan waktu, atau 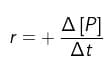 , dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah :
, dengan +Δ[P] = bertambahnya konsentrasi produk (hasil reaksi). Untuk reaksi : A → B, laju bertambahnya zat B adalah : 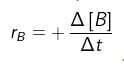
Bagaimana untuk reaksi yang lebih kompleks, semisal : pA + qB → rC.
Untuk reaksi demikian, maka :
Dalam perbandingan tersebut, tanda + atau – tidak perlu dituliskan karena hanya menunjukkan sifat perubahan konsentrasi. Oleh karena harga dt masing-masing sama, maka perbandingan laju reaksi sesuai dengan perbandingan konsentrasi. Di sisi lain, konsentrasi berbanding lurus dengan mol serta berbanding lurus pula dengan koefisien reaksi, sehingga perbandingan laju reaksi sesuai dengan perbandingan koefisien reaksi. Perbandingan tersebut dapat dituliskan sebagai berikut.
rA : rB : rC = p : q : r
Contoh Soal Molaritas :
Berapa gram soda kue (NaHCO3) yang diperlukan untuk membuat 150 mL larutan NaHCO3 0,5 M? (Ar Na = 23, H = 1, C = 12, 0 = 16)
Pembahasan :
Diketahui :
Molaritas NaHCO3 = 0,5 M= 0,5 mol/L
Volume larutan = 150 mL = 0,15 L
Ditanya :
Massa NaHCO3 ?
Jawab :
n =M xV = 0,5 mol/L x 0,15 L = 0,075 mol
massa = mol x Mr = 0,075 x 84 = 6,3 g
Jadi, massa soda kue tersebut adalah 6,3 g.
Artikel Terkait
- asd
- asd
- Sinonim akulturasi adalah kontak kabudayaan #sinonim #bahasa #akulturaasi #bahasaindonesia #antonim
- Pada Suatu Pertemuan, Hadir 10 Orang yang Saling Berjabat Tangan. Banyaknya Jabat Tangan yang Terjadi Adalah... Jawaban dan Pembahasan
- Suku Kelima Suatu Barisan Aritmatika Adalah 22, Sedangkan Kesembilan Adalah 42. Suku Kelima Belas Sama Dengan... Jawaban dan Pembahasan
- Mata Uang yang Sering Digunakan Sebagai Alat Pembayaran dan Kesatuan Hitung Dalam Transaksi Ekonomi dan Keuangan Internasional Disebut...
- Kingdom yang Tidak Memiliki Dinding Sel... Jawaban dan Pembahasan
- Organel Sel yang Berperan Untuk Mendetoksifikasi Racun Adalah... Jawaban dan Pembahasan
- Diketahui Harga 4 kg Jeruk, 1 kg Semangka, dan 2 kg Apel Adalah Rp 54.000,00. Harga 1 kg Jeruk, 2 kg Semangka, dan 2 kg Apel Adalah Rp 43.000,00. Sedangkan Harga 3 kg Jeruk, 1 kg Semangka, dan 1 kg Apel Adalah Rp 37.500,00. Berapakah Harga 1 kg Semangka?
- Nilai Rataan Hitung dari Data 4 10 7 x 10 6 11 Adalah 8 Nilai x Adalah ...